题目内容
10.二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰和O2高温下反应,反应原理为2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g).经研究发现该反应过程为①MnCO3(s)?MnO(s)+CO2 (g) ②2MnO(s)+O2(g)?2MnO2(s).回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰和O2高温下反应的平衡常数表达式K=$\frac{P{{n}_{1}}^{2}}{{n}_{2}({n}_{1}+{n}_{2})}$(用P、n1、n2表示,分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为K=K12×K2.
(2)反应②在一定条件下能自发进行,则其△H<0(填“>”、“<”或“=”).
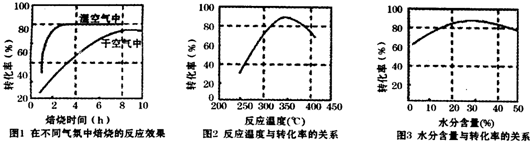
(3)某科研小组对碳酸锰和O2高温下反应制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图.则该制备反应合适的焙烧温度为350℃,合适的水分含量气氛条件为含水量30%.
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,电解后溶液的pH将减小(填“增大”、“减小”或“不变”).
分析 (1)生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;2MnCO3+O2═2MnO2+2CO2为方程①②之和,所以K=K1×K2;
(2)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
(3)由图分析在在指定温度下和水分含量下碳酸锰转化率要高;
(4)阳极发生氧化反应,锰由+2价变成+4价,产生大量的氢离子.
解答 解:(1)反应①的平衡常数表达式K1=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$=$\frac{({P×\frac{{n}_{1}}{{n}_{1}+{n}_{2}})}^{2}}{P×\frac{{n}_{2}}{{n}_{1}+{n}_{2}}}$=$\frac{P{{n}_{1}}^{2}}{{n}_{2}({n}_{1}+{n}_{2})}$,K与反应①、②的平衡常数K1、K2关系为:2MnCO3+O2═2MnO2+2CO2为方程①的系扩大2倍后与②之和所以K=K12×K2,
故答案为:=$\frac{P{{n}_{1}}^{2}}{{n}_{2}({n}_{1}+{n}_{2})}$;K=K12×K2;
(2)反应②在低温下能,只有△H<0,△G<0反应自发,
故答案为:<;
(3)由图2分析,在350℃左右碳酸锰转化率比较高,由图3可知水分含量的30%左右碳酸锰转化率比较高(或20%-40%都正确),
故答案为:350℃;含水量30%;
(4)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,产生大量的氢离子,电解后溶液的pH将减小,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;减小.
点评 本题考查化学平衡常数的含义,平衡移动、电化学相关知识,题目难度中等,试题综合性强,学生要有一定的化学基本功才能解决,试题培养了学生的灵活应用能力.

| A. | 苯 | B. | 丙烯 | C. | 二甲苯 | D. | 己烷 |
| A. | 道尔顿 | B. | 拉瓦锡 | C. | 门捷列夫 | D. | 阿伏加德罗 |
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2+O2=2H2O△H=+285.8 kJ•mol-1 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨不及金刚石稳定 | |
| C. | 在稀溶液中:H++OH-=H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0 )kJ•mol-1 |
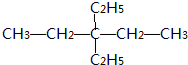
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 4种 |
 .
. .
.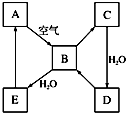 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.