题目内容
20.写出下列反应的化学方程式(1)氯气与水Cl2+H2O?HCl+HClO
(2)过氧化钠与水2Na2O2+2H2O=4NaOH+O2↑
(3)钠与氧气在常温下反应4Na+O2=2Na2O
(4)双氧水分解2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
分析 (1)氯气与水反应生成HCl、HClO,该反应为可逆反应;
(2)过氧化钠与水反应生成NaOH和氧气;
(3)钠与氧气在常温下反应生成氧化钠;
(4)双氧水为过氧化氢的溶液,在二氧化锰等催化剂作用下生成氧气和水.
解答 解:(1)氯气与水发生氧化还原反应,生成HCll、HClO,化学反应方程式为:Cl2+H2O?HCl+HClO,
故答案为:Cl2+H2O?HCl+HClO;
(2)过氧化钠与水反应生成NaOH和氧气,该反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)钠和氧气在常温下反应生成氧化钠白色固体,反应为:4Na+O2=2Na2O,
故答案为:4Na+O2=2Na2O;
(4)双氧水为过氧化氢的溶液,过氧化氢在二氧化锰等催化剂作用下生成氧气和水,反应为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
点评 本题考查了化学方程式的书写,侧重元素化合物知识的考查,把握反应物、生成物及化学反应遵循质量守恒定律为解答的关键,题目难度不大,注意掌握化学方程式的书写方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
8.下列有关物质应用的说法中,不正确的是( )
| A. | 工业上可用Cl2制造漂白粉 | B. | MgO 常用作耐高温材料 | ||
| C. | NaCl用于金属钠的冶炼 | D. | Na2CO3是发酵粉的主要成分之一 |
5.下列卤代烃在KOH醇溶液中加热可以发生消去反应的是( )
①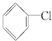 ②
②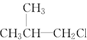 ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤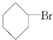 ⑥CH3Cl.
⑥CH3Cl.
①
 ②
②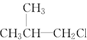 ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ②④ |
12.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
9.含硫酸的三氧化铬(CrO3)遇酒精(C2H5OH)后,其颜色会从红色变成蓝绿色,利用这个现象可判断汽车司机是否酒后驾车,反应式为:2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O,此反应中,硫酸作( )
| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
10. 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )| A. | 该物质的分子式为S4N4 | |
| B. | 该物质的分子中既有极性键又有非极性键 | |
| C. | 该物质的分子中N、S原子均采取sp3杂化 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
 在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).
在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).