题目内容
19.在1~18号元素中,最外层电子数等于电子层数的元素有( )| A. | 3种 | B. | 2种 | C. | 1种 | D. | 4种 |
分析 1~18 号元素,处于短周期,即一、二、三周期,讨论元素所处周期,根据原子核外电子层数等于最外层电子数确定符合条件的元素.
解答 解:1~18 号元素,处于短周期,即一、二、三周期,原子核外电子层数等于最外层电子数:
若处于第一周期,则最外层电子数为1,为H元素;
若处于第二周期,则最外层电子数为2,为Be元素;
若处于第三周期,则最外层电子数为3,为Al元素,
故符合条件的元素共有3种,
故选A.
点评 本题考查结构位置关系应用,比较基础,注意核外电子排布规律的理解掌握.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
7.用48g乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量的乙酸充分反应.下列有关叙述中不正确的是( )
| A. | 生成的水分子中含有18O | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成88g乙酸乙酯 | D. | 不可能生成90g乙酸乙酯 |
14.下列说法正确的是( )
| A. | 通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
8.下列有关物质应用的说法中,不正确的是( )
| A. | 工业上可用Cl2制造漂白粉 | B. | MgO 常用作耐高温材料 | ||
| C. | NaCl用于金属钠的冶炼 | D. | Na2CO3是发酵粉的主要成分之一 |
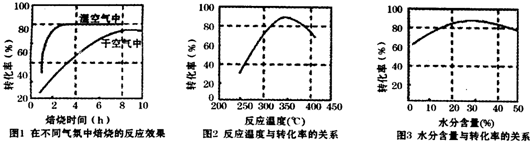
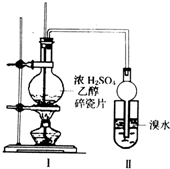 某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.