题目内容
3.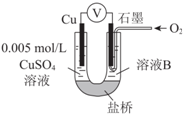 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大.
(1)同学们利用下表中装置进行实验并记录.
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是在金属活动性顺序中,Cu在H后,Cu不能置换出H2;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是O2+4H++4e-=2H2O.
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素.
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的溶液的酸碱性影响.
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰.
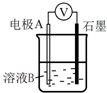
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性).
分析 (1)①Ⅰ中铁主要发生了析氢腐蚀,其正极发生还原反应,书写电极反应式;
②铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极发生还原反应,氧气得电子生成氢氧根离子,其正极的电极反应式是O2+4H++4e-=2H2O;
(2)①实验Ⅱ、Ⅲ、Ⅳ的电解质相同,不同的是氧气的浓度不同,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高;
②实验Ⅳ、Ⅴ是溶液的酸碱性不同,来判断电压表的指针偏转情况;
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰;
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强.
解答 解:(1)①Ⅰ中铁主要发生了析氢腐蚀,其正极发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极发生还原反应,氧气得电子生成氢氧根离子,其正极的电极反应式是O2+4H++4e-=2H2O,故答案为:在金属活动性顺序中,Cu在H后,Cu不能置换出H2;O2+4H++4e-=2H2O;
(2)①实验Ⅱ、Ⅲ、Ⅳ的电解质相同,不同的是氧气的浓度不同,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高,所以O2浓度越大,其氧化性越强,使电压值增大,故答案为:O2浓度越大,其氧化性越强,使电压值增大;
②实验Ⅳ、Ⅴ是溶液的酸碱性不同,来判断电压表的指针偏转情况,所以Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的酸碱性的影响,故答案为:溶液的酸碱性;
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰,故答案为:排除溶液中的Na+(或SO42-)对实验的可能干扰;
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强,
故答案为:排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性).
点评 本题考查了原电池原理的工作原理,通过电压表指针的偏程度来确定外界条件对电极活泼性影响,有一定的难度.

 )与P(
)与P( ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )| A. | 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3:1 | |
| B. | 二者在NaOH醇溶液中均可发生消去反应 | |
| C. | 一定条件下,二者在NaOH溶液中均可发生取代反应 | |
| D. | Q的一氯代物只有1种,P的一溴代物有2种 |
①原子间的相互吸引力叫做化学键 ②两个非金属原子间不可能形成离子键 ③强电解质的分子中一定存在离子键 ④原子之间形成化学键的过程是能量降低的过程 ⑤所有的单质分子中都存在非极性共价键 ⑥全部由非金属元素组成的化合物不一定是共价化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 共价化合物中只含有共价键 | |
| C. | 一个阳离子只可与一个阴离子之间存在离子键 | |
| D. | 金属元素和非金属元素化合一定形成离子键 |
| A. | 气态氢化物的稳定性:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:Y>X>W | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Y的简单离子半径小于Z的简单离子半径 |
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )| A. | 水是弱电解质,某温度下,纯水的pH=6,则说明显酸性 | |
| B. | 可燃冰是可以燃烧的水 | |
| C. | 在相同温度下,水的电离常数与水的离子积常数相等 | |
| D. | 在水中加入Na或NaH,都将促进水的电离 |
| A. | 只有O2 | B. | 只有O2、SO3 | ||
| C. | 只有O2、SO2 | D. | SO2、O2、SO3中都有 |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构. ,CB2的电子式为
,CB2的电子式为 .
. ,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为CH3C≡CCH3.
,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为CH3C≡CCH3. 与CH3C≡CNa反应:
与CH3C≡CNa反应: ;
;