题目内容
14.下列关于化学键的说法正确的是( )①原子间的相互吸引力叫做化学键 ②两个非金属原子间不可能形成离子键 ③强电解质的分子中一定存在离子键 ④原子之间形成化学键的过程是能量降低的过程 ⑤所有的单质分子中都存在非极性共价键 ⑥全部由非金属元素组成的化合物不一定是共价化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
分析 ①原子间的强烈的相互作用叫化学键;
②两个非金属原子间通过共用电子对形成相互作用;
③强电解质中不一定存在离子键;
④断键吸收能量,成键放出能量;
⑤单质中可能不存在化学键;
⑥非金属元素也可能形成离子化合物.
解答 解:①原子间的强烈的相互作用叫化学键,相互作用力包含吸引力和排斥力,故错误;
②两个非金属原子间通过共用电子对形成相互作用,所以两个非金属元素原子间只能形成共价键,不可能形成离子键,故正确;
③强电解质中不一定存在离子键,如HCl、硫酸等强电解质中只含有共价键,故错误;
④断键吸收能量,成键放出能量,所以形成化学键的过程是能量降低的过程,故正确;
⑤单质中可能不存在化学键,如稀有气体中不存在化学键,故错误;
⑥非金属元素也可能形成离子化合物,如氯化铵属于离子化合物,只含有非金属元素,故正确.
故选B.
点评 本题考查了化学键的概念、强弱电解质的判断等知识点,根据物质的构成微粒确定化学键类型,强弱电解质与其电离程度有关,与存在的化学键无关,为易错点.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
2.下列说法正确的是( )
| A. | 含有离子键的化合物必是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 共价化合物可能含离子键 | |
| D. | 离子化合物中一定含有共价键 |
9.下列说法不正确的是( )
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 一种透明液体中加入电解质溶液,若有沉淀生成,则该液体不一定是胶体 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 放电影时,放映室射到银幕上的光柱是由胶粒对光的散射形成的 |
6.下列食物中,属于碱性食物的是( )
| A. | 鸡蛋 | B. | 牛肉 | C. | 鱼 | D. | 黄瓜 |
3.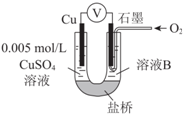 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大.
(1)同学们利用下表中装置进行实验并记录.
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是2H++2e-=H2↑.
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是在金属活动性顺序中,Cu在H后,Cu不能置换出H2;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是O2+4H++4e-=2H2O.
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素.
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是O2浓度越大,其氧化性越强,使电压值增大.
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的溶液的酸碱性影响.
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰.
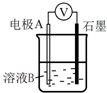
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性).
 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大.
(1)同学们利用下表中装置进行实验并记录.
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是在金属活动性顺序中,Cu在H后,Cu不能置换出H2;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是O2+4H++4e-=2H2O.
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素.
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的溶液的酸碱性影响.
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰.
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性).
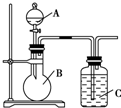 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.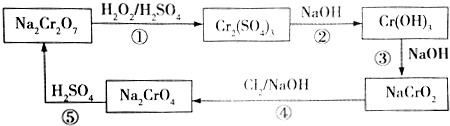
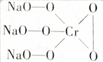 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.