题目内容
8.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )| A. | 气态氢化物的稳定性:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:Y>X>W | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Y的简单离子半径小于Z的简单离子半径 |
分析 短周期元素X、Y、Z、W、Q的原子序数依次增大,Z元素原子半径在短周期中最大(稀有气体除外),则Z为Na;Z、W、Q同周期,只有一种金属元素,故W、Q最外层电子数都大于3,W、Z之间与W、Q之间原子序数之差相等,则W最外层电子数为4,Q最外层电子数为7,可推知W为Si、Q为Cl;X与W处于同一主族,则X为C元素;五种元素原子最外层电子数之和为21,则Y的最外层电子数=21-4-4-1-7=5,原子序数小于Na,故Y为N元素,据此解答.
解答 解:短周期元素X、Y、Z、W、Q的原子序数依次增大,Z元素原子半径在短周期中最大(稀有气体除外),则Z为Na;Z、W、Q同周期,只有一种金属元素,故W、Q最外层电子数都大于3,W、Z之间与W、Q之间原子序数之差相等,则W最外层电子数为4,Q最外层电子数为7,可推知W为Si、Q为Cl;X与W处于同一主族,则X为C元素;五种元素原子最外层电子数之和为21,则Y的最外层电子数=21-4-4-1-7=5,原子序数小于Na,故Y为N元素,
A.元素的非金属性越强,其氢化物越稳定,非金属性:Y>X,则气态氢化物的稳定性:Y>X,故A错误;
B.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,则最高价氧化物对应的水化物的酸性:Y>X>W,故B正确;
C.Cl分别与C、N、Si形成的化合物含有共价键,与Na形成的NaCl含有离子键,化学键类型不相同,故C错误;
D.电子排布相同的离子,原子序数越大,离子半径越小,所以N的简单离子半径大于Na的简单离子半径,故D错误;
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意充分利用非金属元素最外层电子特点及W、Z之间与W、Q之间原子序数之差相等进行推断,难度中等,侧重于考查学生的分析能力.

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丙烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
| A. | NCl3分子是非极性分子 | |
| B. | 分子中的所有原于均达到8电子稳定结构 | |
| C. | NBr3的熔点比NCl3的熔点低 | |
| D. | 分子中N-C1键键长比CCl4分子中C-C1键键长长 |
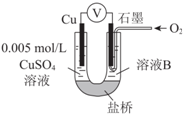 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大.
(1)同学们利用下表中装置进行实验并记录.
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是在金属活动性顺序中,Cu在H后,Cu不能置换出H2;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是O2+4H++4e-=2H2O.
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素.
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的溶液的酸碱性影响.
③实验Ⅳ中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰.
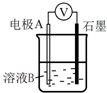
④为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性).
| A. | 苯酚和乙酸都能与NaOH溶液反应 | |
| B. | 甲酸可发生银镜反应,而乙酸不能 | |
| C. | 苯酚能与氢氧化钠溶液反应 而乙醇不行 | |
| D. | 乙烯可发生加成反应,而乙烷不能 |
| A. | c(SO3)=0.15mol•L-1 | B. | c(SO3)=c(SO2)=0.075 mol•L-1 | ||
| C. | c(SO3)=0.2 mol•L-1 | D. | c(O2)=0.05 mol•L-1 |

| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物ZW2具有强还原性 | D. | 化合物Y2Z2中只含共价键 |