题目内容
10.现有两种金属组成的混合物,把5.6g 该混合物加入到100g一定溶质质量分数的稀硫酸中,恰好完全反应,产生氢气物质的量为w.则下列说法中正确的是( )| A. | 若混合物为Zn、Al,w不可能是0.1mol | |
| B. | 若混合物为Zn、Fe,w可能大于0.1mol | |
| C. | 若混合物为Fe、Mg,则加入的稀硫酸中溶质质量分数等于9.8% | |
| D. | 若混合物为Cu、Fe,w是0.05mol,则混合物中Fe与Cu的质量比为1:1 |
分析 A.根据反应方程式利用极值法进行计算;
B.根据铁、锌与稀硫酸反应的方程式利用极值法分析;
C.镁和稀硫酸反应生成硫酸镁和氢气;
D.铜不与稀硫酸反应,根据反应方程式计算出铁的质量,然后计算出二者质量比.
解答 解:A.锌、铝和稀硫酸反应的化学方程式及其质的量关系为:Zn+H2SO4═ZnSO4+H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑,
65g 1mol 54g 3mol
由以上关系可知,5.6g锌和稀硫酸恰好完全反应生成的氢气小于0.1mol,5.6g铝和稀硫酸恰好完全反应生成的氢气大于0.1mol,因此若混合物为Zn、Al,w可能是0.1mol,故A错误;
B.铁和稀硫酸反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑,
56g 1mol,
5.6g铁和稀硫酸恰好完全反应生成的氢气的物质的量为0.1mol,由A中可知,5.6g锌和稀硫酸恰好完全反应生成的氢气小于0.1mol,因此若混合物为Fe、Zn,w一定小于0.1mol,w不可能大于0.1mol,故B错误;
C.设5.6g铁消耗硫酸的质量为y,5.6g镁消耗硫酸的质量为z,
Fe+H2SO4═FeSO4+H2↑,Mg+H2SO4═MgSO4+H2↑,
56 98 24 98
5.6g y 5.6g z
则:$\frac{56}{5.6g}$=$\frac{98}{y}$,$\frac{24}{5.6g}$=$\frac{98}{z}$,
y=9.8g,z=22.9g,
则加入的稀硫酸中溶质质量分数最小为:$\frac{9.8g}{100g}$×100%=9.8%,稀硫酸中溶质的最大质量分数为:$\frac{22.9g}{100g}$×100%=22.9%,所以该硫酸的质量分数一定大于9.8%,故C错误;
D.设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56g 1mol
x 0.05mol
则:$\frac{56g}{x}=\frac{1mol}{0.05mol}$,
解得:x=2.8g,
则混合物中Fe和Cu的质量比为:2.8g:(5.6g-2.8g)=1:1,故D正确;
故选D.
点评 本题考查混合物反应的计算,题目难度中等,试题侧重考查学生运用假设法和化学方程式进行计算和推断的能力,试题培养了学生的分析能力及化学计算能力.

| X | Y | Z | M | |
| A | N2 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
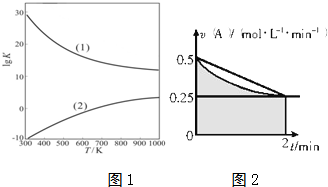
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1.


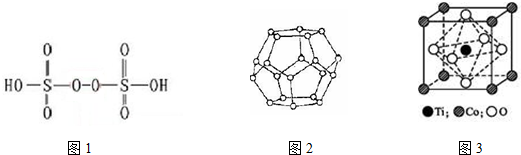
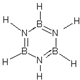 ,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.
,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.