题目内容
5.W粒子的结构如图所示,下列关于它的说法不正确的是( )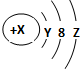
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |
分析 A.第一电子层容纳2个电子,故Y=2;
B.W粒子可能是阴离子、阳离子或中性原子;
C.若X=17,则W为氯元素,最高价氧化物是Cl2O7;
D.若X=14,则为Si元素,氢化物的化学式为SiH4.
解答 解:A.微粒有3个电子层,第一电子层填充满电子,第一电子层容纳2个电子,故Y=2,故A正确;
B.W粒子为中性原子,若X=18,则Z=8,但W也可能是阴离子或阳离子,质子数不等于核外电子数,故B错误;
C.若X=17,则W为氯元素,最高价氧化物是Cl2O7,符合W2O7,故C正确;
D.若X=14,则为Si元素,氢化物的化学式为SiH4,不符合H2W,故D错误;
故选BD.
点评 本题考查核外电子排布规律、微粒中质子数与电子数关系、结构位置性质关系等,比较基础,注意W粒子可能是阴离子、阳离子或中性原子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.有机物 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
16.a、b、c、d、e、f、g、h为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是四原子分子,h是五原子分子;c与f作用可生成2个中性分子g.下列说法不正确的是( )
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
20.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
10.在一定条件下,可逆反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 单位时间内形成x mol的A-A键,同时形成x mol的A-B键 | |
| B. | 容器内的总压强不随时间变化,气体的密度不再随时间变化 | |
| C. | A2、AB、B2的浓度不再随时间改变 | |
| D. | 单位时间内生成x mol的A2分子,同时生成x mol的B2分子 |
17.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成化合物BA3 | |
| B. | C、D、E形成的化合物与A、B、C形成的化合物可能发生氧化还原反应 | |
| C. | A2C2和D2C2具有完全相同类型的化学键 | |
| D. | E的最高价氧化物对应的水化物一定具有强的氧化性 |
15.分子式为C9H10O2,能与NaHCO3溶液反应放出CO2气体,且苯环上的一氯代物有两种的有机物有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
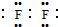 ;
;
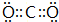 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp.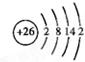 ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3