题目内容
14.表为长式周期表的一部分,其中的编号代表对应的元素
请回答下列问题:
(1)表中属于d区元素的是⑨⑩(填元素符号).元素⑪的名称是砷
(2)表中元素①与元素②可以形成10电子的分子X,X分子的空间构型为正四面体;②和③按原子个数比1:2形成分子Y,Y分子的电子式为
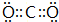 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp.(3)某元素原子的外围电子排布式为nsnnpn+1,该元素为P(填元素符号);该元素与元素①形成的最简单分子X属于极性分子(填“极性”或“非极性”).
(4)元素④、⑤、⑥的第一电离能由大到小的顺序是Mg>Al>Na;
(5)元素⑨的基态原子核外电子排布式是1s22s22p63s23p63d54s1.
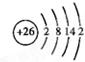
(6)⑩的原子结构示意图是
 ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3(7)元素⑦、⑧的非金属性较强的是Cl(用元素符号表示),并设计实验验证Cl2+Na2S=S↓+2NaCl(用化学反应方程式表示).
分析 由元素在周期表中位置可知,①为H、②为C、③为O、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Cr、⑩为Fe、⑪为As.
(1)d区元素包含3-10列元素,第三列中镧系元素、锕系元素除外;元素⑪位于第四周期15列,即第四周期VA族;
(2)元素①与元素②可以形成10电子的分子X为CH4;②和③按原子个数比1:2形成分子Y为CO2;
(3)某元素的外围电子排布式为nsnnpn+1,而n=2,则外围电子排布式为2s22p3,故为P元素;与氢元素形成的最简单分子为PH3,为三角锥形结构;
(4)同周期随原子序数增大,元素第一电离能呈增大趋势,Mg原子原子3s轨道为全满稳定状态,第一电离能高于同周期相邻元素的;
(5)元素⑨处于第四周期VIB族;
(6)⑩为Fe,核外电子数为26,根据核外电子排布规律画出原子结构示意图;元素⑪位于第四周期VA族;
(7)同周期自左而右非金属性增强,可以根据单质之间的相互置换反应进行验证.
解答 解:由元素在周期表中位置可知,①为H、②为C、③为O、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Cr、⑩为Fe、⑪为As.
(1)d区元素包含3-10列元素,第三列中镧系元素、锕系元素除外,⑨⑩号元素处于d区,元素⑪位于第四周期15列,即第四周期VA族,为砷元素,
故答案为:⑨⑩;砷;
(2)元素①与元素②可以形成10电子的分子X为CH4,为正四面体结构,②和③按原子个数比1:2形成分子Y为CO2,电子式为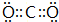 ,为直线形结构,C原子采取sp杂化,
,为直线形结构,C原子采取sp杂化,
故答案为:正四面体;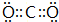 ;sp;
;sp;
(3)某元素的外围电子排布式为nsnnpn+1,而n=2,则外围电子排布式为2s22p3,故为P元素,与氢元素形成的最简单分子为PH3,为三角锥形结构,正负电荷重心不重合,属于极性分子,
故答案为:P;极性;
(4)同周期随原子序数增大,元素第一电离能呈增大趋势,Mg原子原子3s轨道为全满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:Mg>Al>Na,
故答案为:Mg>Al>Na;
(5)元素⑨处于第四周期VIB族,核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(6)⑩为Fe,核外电子数为26,原子结构示意图为 ;元素⑪位于第四周期VA族,价电子排布式为4s24p3,
;元素⑪位于第四周期VA族,价电子排布式为4s24p3,
故答案为: ;4s24p3;
;4s24p3;
(7)同周期自左而右非金属性增强,故Cl的非金属性更强,可以根据单质之间的相互置换反应进行验证,反应方程式为:Cl2+Na2S=S↓+2NaCl,
故答案为:Cl;Cl2+Na2S=S↓+2NaCl.
点评 本题是对物质结构的考查,题目综合性强,涉及元素周期表与元素周期律、核外电子排布、电子式、空间构型与杂化方式、分子极性等,难度中等,需要学生具备扎实的基础,注意同周期第一电离能异常情况.

| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验Ⅰ和Ⅳ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体.(Na2C2O4相对分子质量为134)
②将WgNa2C2O4配成100mL标准溶液,置于锥形瓶中,
酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.
③若酸性KMnO4消耗了40mL,则酸性KMnO4的物质的浓度为$\frac{W}{13.4}$ mol/L(填表达式,用W表示).
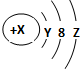
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |
| A. | 原子最外层电子数:Z>X=R>Y | |
| B. | Z与R形成的化合物中R显正价 | |
| C. | 离子半径:X2->Y+>R2->Z- | |
| D. | 四种元素中X元素形成的氢化物沸点最低 |
| A. | Na+ | B. | Mg2+ | C. | S2- | D. | Cl- |
| A. | 1.0 L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2N0 | |
| B. | 常温常压下,8gO2含有4 N0个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
| A. | 用纯碱溶液清洗餐具上油污 | B. | 用稀硫酸清洗水壶里水垢 | ||
| C. | 用漂白液洗涤白衬衣上红色墨迹 | D. | 用汽油清洗皮肤上的油漆 |
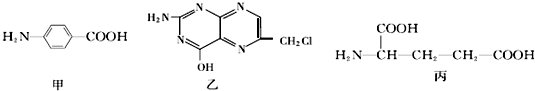
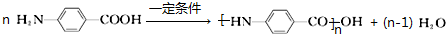
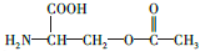 .
.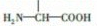 片段
片段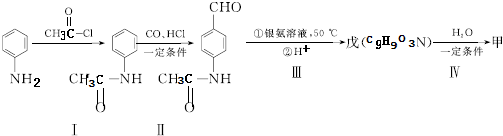
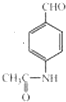 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$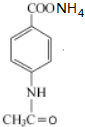 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.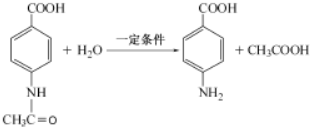 .
.