题目内容
如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉.

试回答:
(1)写①中的离子方程式为 ;
(2)C试剂是 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ;
(5)H中的离子方程式为 .

试回答:
(1)写①中的离子方程式为
(2)C试剂是
(3)E中干燥红色布条
(4)F管中现象
(5)H中的离子方程式为
考点:氯气的实验室制法,氯气的化学性质
专题:卤族元素
分析:(1)依据实验室是利用二氧化锰和浓盐酸加热反应生成氯气书写化学方程式;
(2)用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气;
(3)E是收集氯气检验氯气是否具有漂白性的实验验证,氯气无漂白性;
(4)F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟;
(5)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
(2)用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气;
(3)E是收集氯气检验氯气是否具有漂白性的实验验证,氯气无漂白性;
(4)F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟;
(5)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答:
解:(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,所以C中试剂为饱和食盐水,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,所以D中试剂作用为吸收氯气中的水蒸气,故答案为:饱和食盐水;
(3)E是收集氯气检验氯气是否具有漂白性的实验验证,氯气无漂白性,干燥的有色布条不褪色,故答案为:不褪色;
(4)F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟,反应的化学方程式为Cu+Cl2
CuCl2,故答案为:产生棕黄色的烟;
(5)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,所以C中试剂为饱和食盐水,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,所以D中试剂作用为吸收氯气中的水蒸气,故答案为:饱和食盐水;
(3)E是收集氯气检验氯气是否具有漂白性的实验验证,氯气无漂白性,干燥的有色布条不褪色,故答案为:不褪色;
(4)F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟,反应的化学方程式为Cu+Cl2
| ||
(5)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评:本题考查了实验室制备氯气的装置分析和除杂试剂选择,氯气性质验证的反应现象判断,注意氯气是有毒气体,不能排放到空气中,题目较简单.

练习册系列答案
相关题目
下列除杂质(括号内为杂质)方法合理的是( )
| A、Fe3+(Fe2+),加过量铁粉,过滤 |
| B、Mg2+(Al3+),加过量氨水,过滤 |
| C、CO2(HCl),通过碳酸钠饱和溶液,洗气 |
| D、固体Na2CO3(NaHCO3),加热至恒重 |



 为原料制备
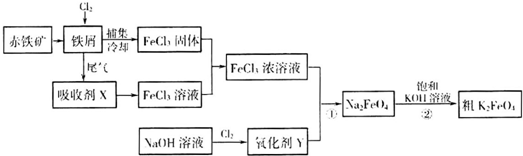
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: .
.


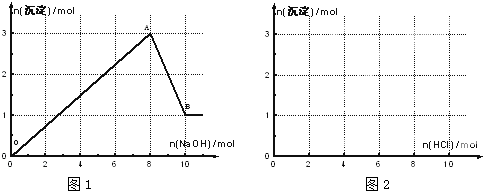
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.