题目内容
铁及其化合物在日常生活、生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.
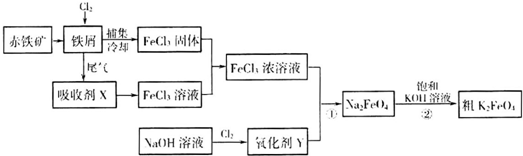
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0kJ?mol-1
②C(石墨)+CO2(g)═2CO(g)△H=+172.5kJ?mol-1
用赤铁矿为原料在高炉炼铁过程中发生的主要反应为
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H= kJ?mol-1.
(2)吸收剂x的溶质为 (写化学式).
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
(4)过程②是在某低温下进行的,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”).
假定此过程中Na2FeO4完全转化为K2FeO4,若最终制得粗产品K2FeO4 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是 t.
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 .

请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0kJ?mol-1
②C(石墨)+CO2(g)═2CO(g)△H=+172.5kJ?mol-1
用赤铁矿为原料在高炉炼铁过程中发生的主要反应为
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=
(2)吸收剂x的溶质为
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
(4)过程②是在某低温下进行的,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH,说明此温度下Ksp(K2FeO4)
假定此过程中Na2FeO4完全转化为K2FeO4,若最终制得粗产品K2FeO4 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
放电时电池的负极反应式为
考点:制备实验方案的设计
专题:实验设计题
分析:(1)依据热化学方程式 和盖斯定律计算分析判断;
(2)从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X反应生成FeCl3溶液;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-;
(4)从难溶电解质的沉淀转化的角度分析;根据方程式中物质之间的转化关系计算;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌.
(2)从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X反应生成FeCl3溶液;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-;
(4)从难溶电解质的沉淀转化的角度分析;根据方程式中物质之间的转化关系计算;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌.
解答:
解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;
(2)通过工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液,
故答案为:FeCl2;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-、次氯酸钠被还原为氯离子,则反应的离子方程式为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
(4)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4);
已知2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O,2KOH+Na2FeO4═K2FeO4+2NaOH,
则 3NaClO~2Na2FeO4~2K2FeO4,
3×74.5 2×396
m 206.25t×96%
则m=
=55.875t;
故答案为:<;55.875;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌,则负极的电极反应式为:Zn+2OH--2e-═Zn(OH)2;
故答案为:Zn+2OH--2e-═Zn(OH)2.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为:-28.5;
(2)通过工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液,
故答案为:FeCl2;
(3)“84消毒液”的有效成分为NaClO,与FeCl3反应生成FeO42-、次氯酸钠被还原为氯离子,则反应的离子方程式为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O;
(4)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4);
已知2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O,2KOH+Na2FeO4═K2FeO4+2NaOH,
则 3NaClO~2Na2FeO4~2K2FeO4,
3×74.5 2×396
m 206.25t×96%
则m=
| 3×74.5×206.25t×96% |
| 2×396 |
故答案为:<;55.875;
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,放电时为原电池,Zn在负极失电子生成氢氧化锌,则负极的电极反应式为:Zn+2OH--2e-═Zn(OH)2;
故答案为:Zn+2OH--2e-═Zn(OH)2.
点评:本题考查了物质的制备流程的理解应用、实验基本操作、物质性质的分析应用、反应热的计算、电极方程式的书写等,题目涉及的知识点较多,侧重于考查学生的实验能力和对基础知识的综合应用能力,熟练掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
水溶液X中只可能溶有K+、Ca2+、A102-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶有进行了如下实验下列判断正确的是( )


| A、气体甲的摩尔质量为44 |
| B、沉淀甲是硅酸和硅酸钙的混合物 |
| C、K+、CO32-、A102-和SiO32-一定存在于溶液X中 |
| D、SO42-一定不存在于溶液X中 |
下列叙述正确的是( )
| A、物质燃烧不一定是放热反应 |
| B、放热反应不需要从外界吸收任何能量就能发生 |
| C、在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D、化学反应除了生成新的物质外,还伴随着能量的变化 |


 +H2O(R1、R2、R3为烃基或氢原子)
+H2O(R1、R2、R3为烃基或氢原子) 中含有酚羟基所用的试剂是
中含有酚羟基所用的试剂是 有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺
有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺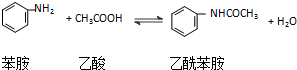


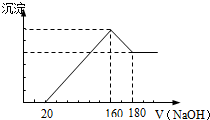 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶 液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)反应过程中涉及的化学方程式
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶 液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)反应过程中涉及的化学方程式