题目内容
下列物质:①NaCl固体②无水乙醇③稀硫酸④BaSO4固体⑤冰醋酸⑥H2⑦CO2⑧熔融的KOH(选序号填空)
(1)能导电: (2)非电解质: (3)强电解质: (4)弱电解质:
(5)已知25℃时两种酸的电离常数:Ka(CH3COOH)=1.75×10-5,Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需.CH3COOH+Ca(ClO)2 .
(1)能导电:
(5)已知25℃时两种酸的电离常数:Ka(CH3COOH)=1.75×10-5,Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需.CH3COOH+Ca(ClO)2
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:(1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可导电;
(2)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(3)根据强电解质的定义分析,强电解质在水溶液或熔融状态下,能完全电离成离子;包括强酸、强碱、盐、活泼金属氧化物等;
(4)弱电解质是指:在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐;
(5)根据电离常数越大,酸性越强,以及相对强酸制取弱酸原理分析.
(2)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(3)根据强电解质的定义分析,强电解质在水溶液或熔融状态下,能完全电离成离子;包括强酸、强碱、盐、活泼金属氧化物等;
(4)弱电解质是指:在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐;
(5)根据电离常数越大,酸性越强,以及相对强酸制取弱酸原理分析.
解答:
解:①氯化钠固体不导电,氯化钠在水溶液中或熔融状态下电离出自由移动的钠离子和氯离子,能导电,它是化合物,属于强电解质;
②乙醇是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质;
③稀硫酸中存在自由移动的离子,能导电,稀硫酸属于混合物,既不是电解质也不是非电解质;
④BaSO4固体没有自由移动的离子不导电; 虽然硫酸钡在水中的溶解度很小,但硫酸钡只要溶解就完全电离且在熔融状态下能够完全电离,所以硫酸钡属于强电解质;
⑤冰醋酸不导电,冰醋酸在水溶液中部分电离属于弱电解质;
⑥氢气是单质,没有自由移动的电子,不能够导电;既不是电解质也不是非电解质;
⑦二氧化碳中只存在二氧化碳分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
⑧熔融氢氧化钾中存在自由移动离子,能导电,属于强电解质;
根据以上分析可知:
(1)能导电的为:③⑧,故答案为:③⑧;
(2)属于非电解质的为:②⑦,故答案为:②⑦;
(3)属于强电解质的为:①④⑧,故答案为:①④⑧;
(4)属于弱电解质的为:⑤,故答案为:⑤;
(5)因Ka(CH3COOH)=1.75×10-5,Ka(HClO)=3.0×10-8,则醋酸酸性比次氯酸强,根据相对强酸制取弱酸原理可知,CH3COOH和Ca(ClO)2能发生反应,反应方程式为:2CH3COOH+Ca(ClO)2=(CH3COO)2Ca+2HClO,故答案为:2CH3COOH+Ca(ClO)2=(CH3COO)2Ca+2HClO.
②乙醇是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质;
③稀硫酸中存在自由移动的离子,能导电,稀硫酸属于混合物,既不是电解质也不是非电解质;
④BaSO4固体没有自由移动的离子不导电; 虽然硫酸钡在水中的溶解度很小,但硫酸钡只要溶解就完全电离且在熔融状态下能够完全电离,所以硫酸钡属于强电解质;
⑤冰醋酸不导电,冰醋酸在水溶液中部分电离属于弱电解质;
⑥氢气是单质,没有自由移动的电子,不能够导电;既不是电解质也不是非电解质;
⑦二氧化碳中只存在二氧化碳分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
⑧熔融氢氧化钾中存在自由移动离子,能导电,属于强电解质;
根据以上分析可知:
(1)能导电的为:③⑧,故答案为:③⑧;
(2)属于非电解质的为:②⑦,故答案为:②⑦;
(3)属于强电解质的为:①④⑧,故答案为:①④⑧;
(4)属于弱电解质的为:⑤,故答案为:⑤;
(5)因Ka(CH3COOH)=1.75×10-5,Ka(HClO)=3.0×10-8,则醋酸酸性比次氯酸强,根据相对强酸制取弱酸原理可知,CH3COOH和Ca(ClO)2能发生反应,反应方程式为:2CH3COOH+Ca(ClO)2=(CH3COO)2Ca+2HClO,故答案为:2CH3COOH+Ca(ClO)2=(CH3COO)2Ca+2HClO.
点评:本题考查了电解质溶液导电的原因及强、弱电解质、非电解质的定义及弱电解质的比较,注意物质导电的原因指含有自由移动的离子或自由电子的物质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
为确定某溶液的离子组成,进行如下实验:根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
将表面已经完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、硝酸铜 |
| C、稀盐酸 | D、氢氧化钠溶液 |



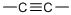 ,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为
,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为