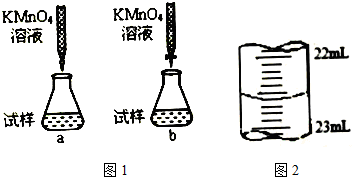
题目内容
7.某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:A.在250mL的容量瓶中配制250mL烧碱溶液
B.用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中滴加几滴酚酞做指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL
E.在锥形瓶下一张白纸,滴定至红色刚好消失为止,记下读数V2mL
回答下列问题:
(1)正确操作步骤的顺序是(填字母):C→A→B→D→E.
(2)滴定管读数时应注意滴定管要直立,装液后需等1~2min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01mL.
(3)操作E中的锥形瓶下垫一张白纸的作用是便于观察溶液颜色的变化.
(4)操作D中液面应调整到“0”或“0”以下某一刻度,尖嘴部分应充满溶液,无气泡.
(5)某学生实验时把锥形瓶用烧碱溶液润洗,使测定的浓度偏高(填“偏高”.“偏低”或“无影响”),原因是因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高.
(6)该烧碱样品纯度的计算式为$\frac{0.8m({V}_{2}-{V}_{1})}{W}$×100%.
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,读数时视线与液体的凹液面及刻度线在同一水平面上,注意滴定管的精确度;
(3)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(4)滴定管“0”刻度在上,滴定前应调节到“0”或“0”以下某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(5)锥形瓶不需要洗涤,否则待测液中溶质的物质的量偏大,滴定过程中消耗的标准液体积偏大,则测定的浓度偏高;
(6)先求出反应消耗的硫酸的物质的量,再根据关系式:2NaOH~H2SO4求出氢氧化钠的物质的量,进一步求出样品的纯度.
解答 解:(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中滴加几滴酚酞做指示剂,将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL,在锥形瓶下一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E;
故答案为:C、A、B、E;
(2)观察滴定管液面的高度时需要注意:滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL,
故答案为:滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL;
(3)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,方法是垫一张白张是为了便于观察溶液颜色的变化,易于判断滴定终点;
故答案为:便于观察溶液颜色的变化;
(4)滴定管“0”刻度在上,滴定前应调节到“0”或“0”以下某一刻度,为减小误差,尖嘴部分应充满溶液,无气泡;
故答案为:“0”或“0”以下某一刻度;充满溶液,无气泡;
(5)中和滴定中,锥形瓶不能用待测液润洗,否则因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,导致测定出的烧碱浓度偏高,
故答案为:偏高;因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高;
(6)滴到消耗的H2SO4的物质的量n(H2SO4)=cV=(V2-V1)×10-3L×m mol/L,根据关系式:2NaOH~H2SO4可知,n(NaOH)=2n(H2SO4)=2m(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为2m(V2-V1)×10-3mol×$\frac{250}{25}$=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80m({V}_{2-}{V}_{1})×1{0}^{-2}g}{Wg}$×100%=$\frac{0.8m({V}_{2}-{V}_{1})}{W}$×100%;
故答案为:$\frac{0.8m({V}_{2}-{V}_{1})}{W}$×100%.
点评 本题考查了探究烧碱样品的纯度的方法,涉及酸碱中和滴定、质量分数的计算、化学实验基本操作方法的判断等知识,注意掌握中和滴定操作方法,试题培养了学生的分析能力及化学计算、化学实验能力.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
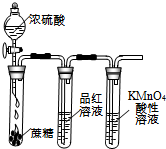
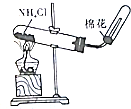
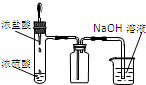
欣语文化快乐暑假沈阳出版社系列答案| A.装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 | B.装置可除去CO2中含有的少量HCl | C.装置可制备氨气 | D.装置可制取、收集并吸收多余的HCl |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 | |
| D. | 改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入 |
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.20mol•L-的盐酸来滴定待测液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol/L,烧碱样品的纯度是97.56%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果偏高
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果无影响.
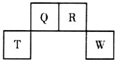 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )