题目内容
16.NA表示阿伏伽德罗常数,下列判断正确的是( )| A. | 32gO2和O3混合气体中含有原子总数为NA | |
| B. | 含有NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为2mol/L | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
分析 A、氧气和臭氧均由氧原子构成;
B、氧化钠溶于1L水中后,溶液体积大于1L;
C、空气中不止是单质分子;
D、求出甲烷和水的物质的量,然后根据甲烷和水均为10电子微粒来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故32g混合物中含2mol氧原子即2NA个氧原子,故A错误;
B、氧化钠溶于1L水中后,溶液体积大于1L,故溶液中钠离子的浓度小于2mol/L,故B错误;
C、空气中不止是单质分子,还有化合物分子,故标况下22.4L空气即1mol空气中单质分子个数小于NA个,故C错误;
D、标况下22.4L甲烷和18g水的物质的量均为1mol,而甲烷和水均为10电子微粒,故1mol甲烷和1mol水中均含10NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
7. 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)从实验装置上看,图中尚缺少的玻璃用品是环形玻璃搅拌棒.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果;
(3)做一次完整的中和热测定实验,温度计需使用3次;
(4)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g•°C)],轻轻搅动,测得酸碱混合液的温度变化数据如表:
①计算上述两组实验测出的中和热:提示$△H=-\frac{{0.4184({t_2}-{t_1})}}{{n({H_2}O)}}kJ/mol$2△H1=-56.9kJ/mol;
△H2=-52.7kJ/mol.
②两组实验结果差异的原因是一水合氨为弱碱,在中和过程中一水合氨发生电离,要吸收热量,因而总体放热较少.
 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:(1)从实验装置上看,图中尚缺少的玻璃用品是环形玻璃搅拌棒.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果;
(3)做一次完整的中和热测定实验,温度计需使用3次;
(4)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g•°C)],轻轻搅动,测得酸碱混合液的温度变化数据如表:
| 反应物 | 起始温度t1/°C | 终了温度t2/°C | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
△H2=-52.7kJ/mol.
②两组实验结果差异的原因是一水合氨为弱碱,在中和过程中一水合氨发生电离,要吸收热量,因而总体放热较少.
11.下列反应中,不属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | H2+Cl2═2HCl | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | Fe+CuSO4═FeSO4+Cu |
1.已知温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mLb mol•L-1的一元碱BOH充分混合,下列判断一定正确的是( )
| A. | 若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化 | |
| B. | 若pH(HA)+pH(BOH)=14,则V1=V2时,酸碱恰好完全中和 | |
| C. | 此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-) | |
| D. | 若混合溶液中c(B+)=c(A-),则此溶液一定呈中性 |
5.下列事实与电化学原理无关的是( )
| A. | 金属钠与氧气反应生成过氧化钠 | |
| B. | 铁制器件在潮湿空气中生锈 | |
| C. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| D. | 远洋海轮的外壳连接锌块可保护轮般不受腐蚀 |
6.下列物质能与SO2气体起反应,但无沉淀产生的是( )
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3⑤稀H2SO4 ⑥Na2SO4 ⑦Na2SO3.
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3⑤稀H2SO4 ⑥Na2SO4 ⑦Na2SO3.
| A. | 只有① | B. | ①④⑤ | C. | ④⑥⑦ | D. | ①④⑦ |
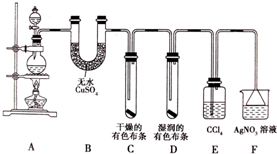 某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):