题目内容
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如图:

(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 , .
(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g);△H=-1266.8kJ/mol
N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mol,氨催化氧化的热化学方程式为 .
(3)500℃下,在A、B两个容器中均发生合成氨的反应.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.

①当合成氨在容器B中达平衡时,测得其中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L.则此条件下的平衡常数为 ;保持温度和压强不变,向此容器中通入0.36mol N2,平衡将 (填“正向”、“逆向”或“不”)移动.
②向A、B两容器中均通入x mol N2和y mol H2,初始A、B容积相同,并保持温度不变.若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为 .

(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g);△H=-1266.8kJ/mol
N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mol,氨催化氧化的热化学方程式为
(3)500℃下,在A、B两个容器中均发生合成氨的反应.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.

①当合成氨在容器B中达平衡时,测得其中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L.则此条件下的平衡常数为
②向A、B两容器中均通入x mol N2和y mol H2,初始A、B容积相同,并保持温度不变.若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为
考点:等效平衡,热化学方程式,化学平衡建立的过程,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)图②是表示N2、H2被吸附在催化剂的表面;图③则表示在催化剂表面,N2、H2中的化学键断裂;
(2)利用盖斯定律,把第二个热化学方程式两边扩大2倍,然后两个方程式相加就可以得到氨催化氧化的热化学方程式;
(3)①依据平衡常数概念计算,用平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;依据计算的浓度商和平衡常数比较分析判断反应进行的方向;
②依据化学平衡三段式列式计算A的体积分数相等列式计算.
(2)利用盖斯定律,把第二个热化学方程式两边扩大2倍,然后两个方程式相加就可以得到氨催化氧化的热化学方程式;
(3)①依据平衡常数概念计算,用平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;依据计算的浓度商和平衡常数比较分析判断反应进行的方向;
②依据化学平衡三段式列式计算A的体积分数相等列式计算.
解答:
解:(1)分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol ①
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol ②
①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol;
(3)①若在某件下,反应N2(g)+3H2(g)?2NH3(g)在容器B中达到平衡,测得容器中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L.则此条件下的平衡常数K=
=10;
保持温度和压强不变,向此容器内通入0.36mol N2,此时容器体积为2.4L,所以Q(c)=
=10.6>10,反应逆向进行;
故答案为:10; 逆向;
②向A、B两容器中均通入x mol N2和y mol H2,初始A、B容积相同,并保持温度不变.设A容器中消耗N2物质的量amol,B容器中消耗N2物质的量为bmol,
A容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a y-3a 2a
B容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) b 3b 2b
平衡量(mol) x-b y-3b 2b
若要平衡时保持N2气体在A、B两容器中的体积分数相等,
=
,x:y=(b-a):(b-a),则x:y=1:1,
则起始通入容器中的N2的物质的量x mol与B的物质的量y mol之间必须满足的关系式为x=y=1;故答案为:x=y.
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol ①
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol ②
①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol;
(3)①若在某件下,反应N2(g)+3H2(g)?2NH3(g)在容器B中达到平衡,测得容器中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L.则此条件下的平衡常数K=
(
| ||||
|
保持温度和压强不变,向此容器内通入0.36mol N2,此时容器体积为2.4L,所以Q(c)=
(
| ||||
|
故答案为:10; 逆向;
②向A、B两容器中均通入x mol N2和y mol H2,初始A、B容积相同,并保持温度不变.设A容器中消耗N2物质的量amol,B容器中消耗N2物质的量为bmol,
A容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a y-3a 2a
B容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) b 3b 2b
平衡量(mol) x-b y-3b 2b
若要平衡时保持N2气体在A、B两容器中的体积分数相等,
| x-a |
| x+y-2a |
| x-b |
| x+y-2b |
则起始通入容器中的N2的物质的量x mol与B的物质的量y mol之间必须满足的关系式为x=y=1;故答案为:x=y.
点评:本题主要考查了反应原理、热化学方程式的书写、平衡移动的判断、等效平衡的应用等知识点,中等难度,注意等效平衡原理的应用.

练习册系列答案
相关题目
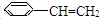 )5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空
)5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空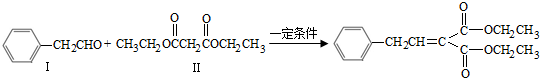
 可合成化合物I.化合物Ⅳ是
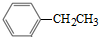
可合成化合物I.化合物Ⅳ是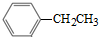 的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为
的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为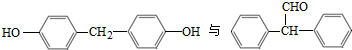 也可以发生类似反应①的反应,产物的结构式为
也可以发生类似反应①的反应,产物的结构式为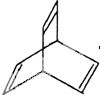 I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写
I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写 为.有机物X的键线式如图:
为.有机物X的键线式如图: