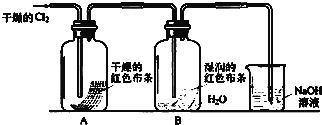
题目内容
在硝酸生成过程中所排放出来的废气中含有NO和NO2,它们污染环境.现用氨催化还原法将它们转化为无毒气体氮气直接排入空气中.写出氨气与一氧化氮的反应方程式: .假设NO和NO2体积比恰好为1:1,由烧碱溶液吸收这种混合气体生成亚硝酸盐的化学方程式 .
考点:氮的氧化物的性质及其对环境的影响
专题:元素及其化合物
分析:根据质量守恒定律的实质可以知道在化学反应前后元素的种类不变,所以结合题目中所给的物质可以解答该题,氨气和一氧化氮反应生成氮气和水,也有很好的和二氧化氮按照1:1和氢氧化钠溶液反应生成亚硝酸钠和水.
解答:
解:根据质量守恒定律的实质可以知道:在催化剂的作用下氨气可以将一氧化氮及二氧化氮转化为无毒的气体,结合所学的知识可以知道该气体应该为氮气,则另一种产物应该为水,氨气与一氧化氮的反应生成氮气和水,该反应的化学方程式为4NH3+6NO
5N2+6H2O;如果NO和NO2物质的量之比恰好为1:1,则氮元素的平均化合价是+
=+3价,所以对应的酸酐是N2O3,相应的钠盐是NaNO3,因此反应的化学方程式是NO+NO2+2NaOH═2NaNO2+H2O.
故答案为:4NH3+6NO
5N2+6H2O;NO+NO2+2NaOH═2NaNO2+H2O.
| ||
| 2+4 |
| 2 |
故答案为:4NH3+6NO
| ||
点评:本题考查了氮及其化合物性质分析,关键是抓住“无毒的气体”,然后根据元素的化合价,即可以准确判断出其产物是氮气,也就是说该反应是氮元素之间发生的氧化还原反应,生成物的价态只能位于中间价态,该题难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.