题目内容
向 99.5mL 0.2mol/L的NaOH溶液中加入 100.5mL 0.1mol/L的H2SO4后,溶液的pH为多少? .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:100.5mL 0.1mol/L的H2SO4 n(H+)=0.1005L×0.1mol/L×2=0.0201mol,99.5mL 0.2mol/L的NaOH溶液n(OH-)=0.0995L×0.2mol/L=0.0199mol,酸过量,反应后溶液呈酸性,计算反应后c(H+),可计算pH.
解答:
解:100.5mL 0.1mol/L的H2SO4 n(H+)=0.1005L×0.1mol/L×2=0.0201mol,99.5mL 0.2mol/L的NaOH溶液n(OH-)=0.0995L×0.2mol/L=0.0199mol,反应后溶液的体积为100.5mL+99.5mL=200mL=0.2L,则反应后c(H+)=
=1×10-3,pH=-lgc(H+),pH=3,
故答案为:3.
| 0.0201mol-0.0199mol |
| 0.2L |
故答案为:3.
点评:本题考查了酸碱反应后溶液酸碱性判断和计算应用,判断溶液中的过量离子是解题关键,题目难度不大.

练习册系列答案
相关题目
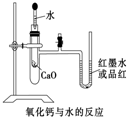 如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置

 现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图:
现需配制0.4mol?L-1 NaOH 溶液480mL.某同学转移溶液的示意图如右图: 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.