题目内容
现有硫酸、盐酸、醋酸三种酸
(1)pH均为3的三种酸,加水稀释后pH都等于5,则加水量最多酸是 ;
(2)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2气体的体积由大到小的顺序是 .
(3)在同体积、同浓度的三种酸中,分别加入适量的金属镁,反应开始时产生气体速率最快的是 .
(4)物质的量浓度为0.1mol?L-1的盐酸、硫酸、醋酸三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol?L-1的三种酸溶液,用0.1mol?L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 .
(1)pH均为3的三种酸,加水稀释后pH都等于5,则加水量最多酸是
(2)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2气体的体积由大到小的顺序是
(3)在同体积、同浓度的三种酸中,分别加入适量的金属镁,反应开始时产生气体速率最快的是
(4)物质的量浓度为0.1mol?L-1的盐酸、硫酸、醋酸三种酸溶液的pH由大到小的顺序是
考点:pH的简单计算,化学反应速率的影响因素
专题:化学反应速率专题,电离平衡与溶液的pH专题
分析:(1)醋酸是弱电解质,在水溶液里只有部分电离,加水稀释促进醋酸电离,氯化氢、硫酸都是强电解质,在水溶液里完全电离,结合强弱电解质特点分析解答;
(2)同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
(3)三种酸中,醋酸为一元弱酸,盐酸为一元强酸,硫酸为二元强酸,等浓度时,溶液中c(H+)大小顺序为硫酸>盐酸>醋酸,c(H+)越大,反应速率越大,以此解答;
(4)根据硫酸是二元强酸完全电离,盐酸是一元强酸完全电离,醋酸是弱酸部分电离分析解答;酸和碱中和时,酸的物质的量和氢氧化钠的物质的量之间成正比例关系;
(2)同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
(3)三种酸中,醋酸为一元弱酸,盐酸为一元强酸,硫酸为二元强酸,等浓度时,溶液中c(H+)大小顺序为硫酸>盐酸>醋酸,c(H+)越大,反应速率越大,以此解答;
(4)根据硫酸是二元强酸完全电离,盐酸是一元强酸完全电离,醋酸是弱酸部分电离分析解答;酸和碱中和时,酸的物质的量和氢氧化钠的物质的量之间成正比例关系;
解答:
解:(1)醋酸是弱电解质,在水溶液里只有部分电离,加水稀释促进醋酸电离,氯化氢、硫酸都是强电解质,在水溶液里完全电离;
pH都等于3的硫酸、盐酸、醋酸,醋酸的浓度大于盐酸、硫酸,加水稀释后醋酸还能电离出氢离子,要使稀释后的溶液pH仍然相等,则醋酸溶液中加入的水要大于盐酸、硫酸溶液中加入的水,所以稀释后醋酸的体积大于盐酸、硫酸,
故答案为:醋酸;
(2)同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是醋酸>硫酸=盐酸,
故答案为:醋酸>硫酸=盐酸;
(3)三种酸中,醋酸为一元弱酸,盐酸为一元强酸,硫酸为二元强酸,等浓度时,溶液中c(H+)大小顺序为硫酸>盐酸>醋酸,c(H+)越大,反应速率越大,则开始时三种溶液中反应速率快慢顺序是硫酸>盐酸>醋酸,
故答案为:硫酸>盐酸>醋酸;
(4)浓度均为0.1mol/L的盐酸、硫酸和醋酸,由于硫酸是二元强酸完全电离其氢离子浓度为0.2mol/L;盐酸是一元强酸完全电离其氢离子浓度为0.1mol/L;醋酸是弱酸部分电离其氢离子浓度小于0.1mol/L,所以pH大小顺序为:醋酸>盐酸>硫酸;
等体积的0.1mol?L-1的三种酸溶液,硫酸是二元酸,消耗的氢氧化钠最多,醋酸和盐酸都是一元酸,物质的量一样,消耗氢氧化钠一样多,所以用0.1mol?L-1的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是:硫酸>盐酸=醋酸;
故答案为:醋酸>盐酸>硫酸;硫酸>盐酸=醋酸.
pH都等于3的硫酸、盐酸、醋酸,醋酸的浓度大于盐酸、硫酸,加水稀释后醋酸还能电离出氢离子,要使稀释后的溶液pH仍然相等,则醋酸溶液中加入的水要大于盐酸、硫酸溶液中加入的水,所以稀释后醋酸的体积大于盐酸、硫酸,
故答案为:醋酸;
(2)同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是醋酸>硫酸=盐酸,
故答案为:醋酸>硫酸=盐酸;
(3)三种酸中,醋酸为一元弱酸,盐酸为一元强酸,硫酸为二元强酸,等浓度时,溶液中c(H+)大小顺序为硫酸>盐酸>醋酸,c(H+)越大,反应速率越大,则开始时三种溶液中反应速率快慢顺序是硫酸>盐酸>醋酸,
故答案为:硫酸>盐酸>醋酸;
(4)浓度均为0.1mol/L的盐酸、硫酸和醋酸,由于硫酸是二元强酸完全电离其氢离子浓度为0.2mol/L;盐酸是一元强酸完全电离其氢离子浓度为0.1mol/L;醋酸是弱酸部分电离其氢离子浓度小于0.1mol/L,所以pH大小顺序为:醋酸>盐酸>硫酸;
等体积的0.1mol?L-1的三种酸溶液,硫酸是二元酸,消耗的氢氧化钠最多,醋酸和盐酸都是一元酸,物质的量一样,消耗氢氧化钠一样多,所以用0.1mol?L-1的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是:硫酸>盐酸=醋酸;
故答案为:醋酸>盐酸>硫酸;硫酸>盐酸=醋酸.
点评:本题考查弱电解质的电离以及化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点,题目难度中等.

练习册系列答案
相关题目
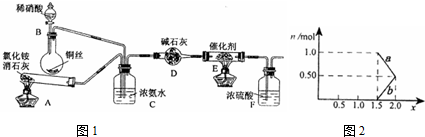
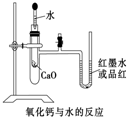 如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置


 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.