题目内容
6.金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”.工业上以金红石为原料制取Ti的反应为:(1)aTiO2+bCl2+cC $\frac{\underline{\;1173k\;}}{\;}$aTiCl4+cCO (2)TiCl4+2Mg $\frac{\underline{\;1220~1420k\;}}{\;}$Ti+2MgCl2关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂
②C、Mg在反应中均为还原剂,发生还原反应
③每生成19.2gTi,反应(1)、(2)中共转移4.8mole-
④a=1,b=c=2.
| A. | ①②④ | B. | ②③④ | C. | ③④ | D. | ②③ |
分析 反应(1)中Ti元素化合价不变,Cl元素化合价降低,氯气为氧化剂,C元素化合价升高,被氧化,C为还原剂,(2)中Ti元素化合价降低,被还原,TiCl4为氧化剂,Mg为还原剂,结合质量守恒定律以及氧化还原反应得失电子数目相等的规律解答该题.
解答 解:①(1)aTiO2+bCl2+cC $\frac{\underline{\;1173k\;}}{\;}$aTiCl4+cCO 该反应中反应前后,碳元素的化合价升高,碳单质作还原剂,氯元素的化合价降低,氯气作氧化剂,还原产物是TiCl4;(2)TiCl4+2Mg $\frac{\underline{\;1220~1420k\;}}{\;}$Ti+2MgCl2该反应中钛元素的化合价降低,TiCl4作氧化剂;所以TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂,故①正确;
②C、Mg在反应中反应前后化合价都升高,所以均为还原剂,发生氧化反应,故②错误;
③将方程式(1)、(2)相加得
TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 转移电子
48g 8mol
19.2g 3.2mol
所以每生成19.2 g Ti,反应(1)、(2)中共转移3.2 mol e-,故③错误;
④根据反应前后各元素的原子个数守恒知,$\left\{\begin{array}{l}{2a=c}\\{2b=4a}\end{array}\right.$所以a=1,b=c=2,故④正确;
故选D.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意基本概念的理解、氧化还原反应中得失电子相等等问题.

| A. | 在0.1mol/lHNO3溶液中加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+═2Fe2++CO2↑+H2O | |
| B. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010的溶液中NO3-、I-、Na+、SO42-不能大量共存 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA |
| A. | 将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 将0.10mol•L-1KHC2O4和0.10mol•L-1K2C2O4溶液等体积混合所得溶液中:2c(K+)=3c(C2O42-)+3c(HCO4) | |
| D. | 将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
| A. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| B. | 用食醋检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 用氯化铁溶液腐蚀铜线路板:Cu+Fe3+═Fe2++Cu2+ | |
| D. | 用氢氧化钠溶液去除铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2↑ |
| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体的量,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大 | |
| D. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 |
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H2 | ||
| C. | 体积相同、密度不相等的CO和C2H4 | D. | 压强相同、体积相同的O2和H2 |
| A. |  实验室制备NO | B. |  实验室制取NH3 | ||
| C. |  收集SO2并验证其还原性 | D. |  验证铜绿受热分解的酸性气体产物 |
| A. | 置换反应一定是氧化还原反应 | |
| B. | 氧化还原反应的实质是化合价发生了变化 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 氧化还原反应中氧化剂发生了氧化反应 |
Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:
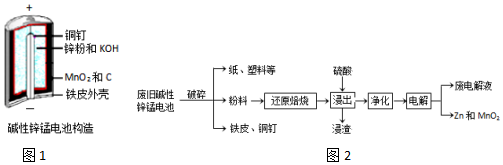
回答下列问题:
(1)MnOOH中,Mn元素的化合价为+3.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有C.
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入H2O2(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mn2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是3至6.
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+.本工艺中应循环利用的物质是H2SO4(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为2MnOOH+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+4H2O+Cl2↑.
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效.如果制造一节电池所需的锌粉为6g,则电池失效时仍有87%的金属锌未参加反应.