��Ŀ����
16������п�̵�����ճ����������������ĵ�أ��乹����ͼ1��ʾ���ŵ�ʱ�ܷ�ӦΪ��Zn+2H2O+2MnO2�TZn��OH��2+2MnOOH
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�����ͼ2��
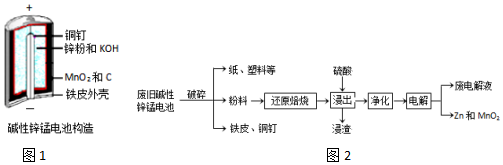
�ش��������⣺
��1��MnOOH�У�MnԪ�صĻ��ϼ�Ϊ+3��
��2������ԭ���ա������У��۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO������Ҫԭ���ǡ����ϡ��к���C��
��3������������Ϊ�˳�ȥ����Һ�е�Fe2+�������ǣ�����H2O2���ѧʽ����Һ��Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ��������֪����Һ��Mn2+��Zn2+��Ũ��ԼΪ0.1mol•L-1�������������ݼ��㣬����pH�ĺ�����Χ��3��6��
| ������ | Mn��OH��2 | Zn��OH��2 | Fe��OH��3 |
| KSP����ֵ | 10-13 | 10-17 | 10-38 |
��4������⡱ʱ�������ĵ缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+����������Ӧѭ�����õ�������H2SO4���ѧʽ����
��5�����������ϡ�ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2�������ϡ��е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ2MnOOH+6HCl$\frac{\underline{\;\;��\;\;}}{\;}$2MnCl2+4H2O+Cl2����
��6��ij����п�̵��ά�ֵ���ǿ��0.5A���൱��ÿ��ͨ��5��10-6 mol���ӣ�����������80���Ӽ��ӽ�ʧЧ���������һ�ڵ�������п��Ϊ6g������ʧЧʱ����87%�Ľ���пδ�μӷ�Ӧ��
���� ��1�����ݻ��ϼ۴�����Ϊ0���㣻
��2-4���Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ���ա������У�̼���۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO�������������ܽ�����п��MnO�õ�MnSO4��Һ������Fe2+��Zn2+�����������м���H2O2��Һ������Fe2+����ΪFe3+���ٵ���pHʹFe3+��ȫ���������յõ�MnSO4��Һ��Zn2+���������Mn2+ʧ���ӷ���������Ӧ����MnO2������Zn2+�õ��ӷ�����ԭ��Ӧ����Zn���ϵ��ҺΪ���ᣬ�ݴ˷������
��5������MnOOH���������ԣ������ᷢ��������ԭ��Ӧ��д��
��6������ÿ��ͨ��5��10-6 mol���Ӽ��������ת�Ƶ���Ŀ���ٽ�ϵ����غ�������ĵ�Zn���������ݴ˼��㣮
��� �⣺��1�����ݻ��ϼ۴�����Ϊ0��MnOOH�У�MnԪ�صĻ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ��+3��
��2���Ͼɼ���п�̵�ط����к���̼���л�ԭ�ԣ�����ԭ���ա������У�̼���۽��������ﱻ��ԭΪ�ͼ��������������ʣ�����MnOOH��MnO2����ԭ��MnO�����ʴ�Ϊ��C��
��3������������Ϊ�˳�ȥ����Һ�е�Fe2+������H2O2��Һ���������Խ�Fe2+����ΪFe3+������Mn��OH��2��Zn��OH��2��KSP����ֵ�����Mn2+��Zn2+��ʼ����ʱ��������Ũ�ȷֱ�Ϊ$\sqrt{\frac{10{\;}^{-13}}{0.1}}$=10-6��$\sqrt{\frac{10{\;}^{-17}}{0.1}}$=10-8����Mn2+��Zn2+��ʼ����ʱ��pH�ֱ�Ϊ8��6����Fe��OH��3������ȫʱ��������Ũ��Ϊ$\root{3}{\frac{10{\;}^{-38}}{1��10{\;}^{-5}}}$=10-11����
Fe��OH��3������ȫʱ��pHΪ3�����Ե���pH�ĺ�����Χ�� 3-6��ʹFe3+��ȫ������Mn2+��Zn2+���������ʴ�Ϊ��H2O2��3��6��
��4���������Mn2+ʧ���ӷ���������Ӧ����MnO2�������ĵ缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+������Zn2+�õ��ӷ�����ԭ��Ӧ����Zn���ϵ��ҺΪ���ᣬ������Ӧѭ�����õ�������H2SO4���ʴ�Ϊ��Mn2+-2e-+2H2O=MnO2+4H+��H2SO4��
��5�������ϡ��е�MnOOH���������ԣ������ᷢ��������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ2MnOOH+6HCl$\frac{\underline{\;\;��\;\;}}{\;}$2MnCl2+4H2O+Cl2�����ʴ�Ϊ��2MnOOH+6HCl$\frac{\underline{\;\;��\;\;}}{\;}$2MnCl2+4H2O+Cl2����
��6��80����ת�Ƶ��ӵ����ʵ���Ϊ5��10-6 mol��80��60=0.024mol�������ĵ�Zn������Ϊ$\frac{0.024mol}{2}$��65g/mol=0.78g�������������һ�ڵ�������п��Ϊ6g������ʧЧʱ����$\frac{6-0.78}{6}$��100%=87%�Ľ���пδ�μӷ�Ӧ���ʴ�Ϊ��87��
���� ���⿼������ķ�����ᴿ�����ؿ���ѧ����֪ʶ���ۺ������������漰���ԭ����������ԭ��Ӧ��֪������ͼ�и������跢���ķ�Ӧ��������������Ŀ�ѶȽϴ�

| A�� | �ֹ��Ʊ������費�漰������ԭ��Ӧ | |
| B�� | �������ཫ̫����ת��Ϊ���ܵij��ò��� | |
| C�� | ��Ӧ��Si+2NaOH+H2O�TNa2SiO3+2H2���У�SiΪ��ԭ����NaOH��H2OΪ������ | |
| D�� | ����������ᷴӦ�������������ᷴӦ |
| A�� | ���ʵĵ��뷽��ʽΪ��NaHCO3�TNa++H++CO32- | |
| B�� | ����Ũ�ȹ�ϵ��c��Na+ ��+c��H+ ���Tc��OH- ��+c��HCO3- ��+c��CO32-�� | |
| C�� | 25��ʱ����ˮϡ�ͺ�n ��H+����n��OH-���ij˻���� | |
| D�� | �¶����ߣ�c��HCO3-������ |
| A�� | 1 mol���ǿ���ˮ������2mo1������ | |
| B�� | ʳ�û������ܷ���ˮ�ⷴӦ | |
| C�� | C2H4C12��C5H12��ֻ������ͬ���칹�� | |
| D�� | ����ϩ�����ڹ�ƽ���̼ԭ�������Ϊ7�� |
| A�� | �����ع��͡��Ƴɷ��������������Դ�������� | |
| B�� | ��Al��OH��3���������ϵ���ȼ������Ϊ�������ۻ��ų��������� | |
| C�� | ����ȼ�����������ͷų��ļ�����������ЧӦ�ļӾ� | |
| D�� | �����ø�ƿ����Һ�Ȼ�Ũ���� |
| ѡ�� | ʵ����������� | ���� |
| A | ������Һ�еμӴ���Ǧ��Һ��������ɫ��������ˮ��������ʧ | �����ʷ����˱��� |
| B | �ⶨŨ�Ⱦ�Ϊ0.1mol•L-1 CH3COONa��HCOONa��Һ��pH��CH3COONa��Һ��pH�ϴ� | ���ԣ�CH3COOH��HCOOH |
| C | ���ӵ���Һ�м���̼������Һ����Һ��Ϊ��ɫ | ���ԣ����ӣ�̼��������Һ |
| D | ��Ũ�Ⱦ�Ϊ0.1mol•L-1 NaCl��NaI�����Һ�еμ�3��0.1mol•L-1 AgNO3��Һ�����ֻ�ɫ���� | �ܽ�ȣ�AgI��AgCl |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | NaCl��Һ�ڵ��������µ����Na+��Cl- | |
| B�� | ����ˮ���ܹ������H+�Ļ����ﶼ���� | |
| C�� | �Ȼ�������ˮ�γɵ���Һ�ܹ����磬�����Ȼ����ǵ���� | |
| D�� | CO2����ˮ�γɵ���Һ�ܹ����磬����CO2�ǵ���� |