题目内容
11.常温下,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 将0.10mol•L-1KHC2O4和0.10mol•L-1K2C2O4溶液等体积混合所得溶液中:2c(K+)=3c(C2O42-)+3c(HCO4) | |
| D. | 将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
分析 A、CH3COONa是强碱弱酸盐水解呈碱性,而CH3COONH4是弱碱弱酸盐,但由于醋酸和一水合氨的电离度相等,所以醋酸铵溶液呈中性,则混合溶液呈碱性;
B、向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性,即c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-);
C、浓度均为0.1mol•L-1 KHC2O4和K2C2O4的混合溶液中,根据物料守恒;
D、根据物料守恒和电荷守恒分析.
解答 解:A、CH3COONa是强碱弱酸盐水解呈碱性,而CH3COONH4是弱碱弱酸盐,但由于醋酸和一水合氨的电离度相等,所以醋酸铵溶液呈中性,则混合溶液呈碱性,钠离子不水解,而铵根离子水解,即c(Na+)>c(NH4+),所以将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-),故A正确;
B、向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性,即c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),则c(Na+)>c(Cl-),故B错误;
C、浓度均为0.1mol•L-1 KHC2O4和K2C2O4的混合溶液中,根据物料守恒可得:2c(K+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4),故C错误;
D、析出晶体后的溶液中溶质可以看作NH4Cl和NaHCO3,溶液中电荷守恒为:c(NH4+)+c(Na+)+c(NH4+)=c(OH-)+2c(CO32-)+c(HCO3-)+c(Cl-),
溶液中物料守恒为c(NH4+)+c(NH3•H2O)+c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)+c(Cl-),则c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3),故D正确.
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| B. | 硅胶是一种无毒无味,吸附水能力强的物质,常用作袋装食品的干燥剂 | |
| C. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 合金的生成常会改善金属单质的性质,日常生活中合金的使用范围远大于纯金属 |
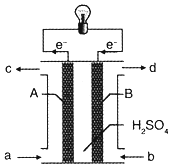 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | A为正极 | |
| B. | 电池工作时H+由A极向B极迁移 | |
| C. | 从b 口通入四氧化二氮气体且在B极发生氧化反应 | |
| D. | A极发生的电极反应式:C2H8N2+4H2O+16e-═2CO2+N2+16H+ |
| A. | 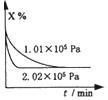 图表示不同压强对反应体系3X(g)?2Y(g)+Z(s)中X体积分数的影响 | |
| B. |  图表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. | 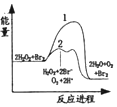 图中的线条2表示放热反应2H2O2═2H2O+O2加入催化剂Br2的反应进程 | |
| D. | 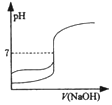 图表示用0.1000mol•L-1NaOH溶液分别滴定同浓度同体积盐酸和醋酸的曲线 |
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
| A. |  | B. |  | C. |  | D. | CH3CH2CH2CH2CH3 |
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是人类将太阳能转换为电能的常用材料 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |