题目内容
8.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
分析 X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子M电子层上有2对成对电子,所以原子核外电子排布式为1s22s22p63s22p4,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;则W原子核外电子数为2+8+18+1=29,则E为Cu元素,据此解答.
解答 解:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子M电子层上有2对成对电子,所以原子核外电子排布式为1s22s22p63s22p4,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;则W原子核外电子数为2+8+18+1=29,则E为Cu元素,
(1)Y为硫元素,是第三周期第ⅥA族元素,Y和Z分别为硫元素和Cl元素,非金属性越强其最高价氧化物对应的水化物的酸性越强,所以是非金属氯最高价氧化物对应的水化物,化学式为HClO4,故答案为:第三周期第ⅥA族;HClO4;
(2)CS2是一种常用的溶剂,二硫化碳分子和二氧化碳分子结构相似,根据二氧化碳分子结构知二硫化碳分子中含有存在2个σ键,键的极性和中心原子的得电子能力相关,得电子能力大,极性强,故氢氯键的极性强于氢硫键,键长取决于中心元素的原子半径,半径大,键长长,故氢氯键长于氢硫键;故答案为:2;H-Cl;H-S;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1.
点评 本题考查了物质的化学性质,正确推断元素是解本题关键,难点是实验设计,根据物质的性质来设计实验即可,难度中等.

| A. |  和 和 | B. | CH3CH2Cl和CH2ClCH2Cl | ||
| C. | C2H6和C5H12 | D. | CH3CH2OH和CH3Cl |
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数:Y>X | D. | 质子数:Y>X |
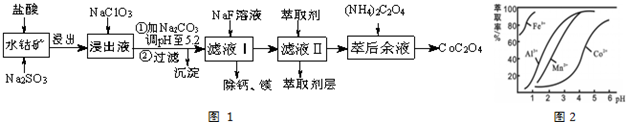
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中Fe2+氧化为Fe3+.
(3)加Na2CO3调PH=5.2能使Fe3+、Al3+离子转化成氢氧化物沉淀,利用平衡移动原理分析的原因是因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH=B(填序号)左右.
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀而除去.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
| A. | 质量数 | B. | 核外电子数 | C. | 中子数 | D. | 质子数 |
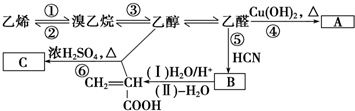
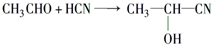 ;加成反应.
;加成反应.