题目内容
18.14C可用于考古,“14”是指( )| A. | 质量数 | B. | 核外电子数 | C. | 中子数 | D. | 质子数 |
分析 14C中含有的质子数为6,质量数为14.
解答 解:14C中含有的质子数为6,质量数为14,故选A.
点评 本题考查原子的构成及原子中的数量关系,明确质子数+中子数=质量数即可解答,题目较简单.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
8.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)Y在元素周期表中的位置是第三周期第ⅥA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
9.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
6.以下性质的比较中,不正确的是( )
| A. | 晶格能 NaCl<MgO | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:P>Cl>S |
13.2SO2(g)+O2(g)?2SO3(g)(正反应放热).下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2能完全转化为SO3 | |
| D. | 达到平衡时,SO2和SO3的浓度一定相等 |
3.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(6)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)在B、C、E、F、G、H中,原子半径最大的是Na
(5)A和D组成化合物的电子式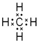
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式2OH-+Al2O3=2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)在B、C、E、F、G、H中,原子半径最大的是Na
(5)A和D组成化合物的电子式

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式2OH-+Al2O3=2AlO2-+H2O.
10.设阿伏加德罗常数为 NA,则下列说法正确的是( )
| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
7.下列关于原电池的叙述中,正确的是( )
| A. | 原电池负极发生的电极反应是还原反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池在工作时其正极不断产生电子经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
8.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |