题目内容
3.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1: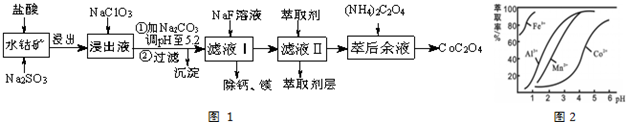
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中Fe2+氧化为Fe3+.
(3)加Na2CO3调PH=5.2能使Fe3+、Al3+离子转化成氢氧化物沉淀,利用平衡移动原理分析的原因是因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
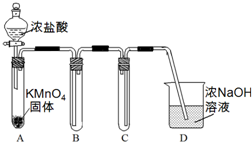
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH=B(填序号)左右.
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀而除去.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
分析 (1)(2)(3)含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴;
(4)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn2+的萃取率增大很多,而pH=4时,Co2+的萃取率比大;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化钙、氟化镁沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$.
解答 解:含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,其中的一个反应离子方程式为:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,
故答案为:将Co3+、Fe3+还原;SO32-+2Fe3++H2O=SO42-+2Fe2++2H+;
(2)NaClO3的作用是:将浸出液中Fe2+氧化为Fe3+,
故答案为:将浸出液中Fe2+氧化为Fe3+;
(3)加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,原因是:因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀,
故答案为:Fe3+、Al3+;因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀;
(4)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn2+的萃取率增大很多,而pH=4时,Co2+的萃取率比较大,故pH=3时最佳,
故答案为:除去Mn2+;B;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,
故答案为:CaF2、MgF2沉淀;0.7.
点评 本题考查物质制备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、溶度积有关计算等,侧重考查学生分析能力、获取信息能力,是对学生综合能力的考查.

| A. | CCl4 | B. | CHCl3 | C. | CH2Cl2 | D. | CH3Cl |
 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
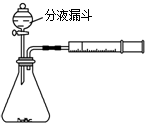
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是收集氯气、防止D中的溶液进入B.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡:Cl2+H2O?HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HC1O的方程式是CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
②烧杯3取用硫酸的体积应为5 mL.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 放热反应的发生无需任何条件 |
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2能完全转化为SO3 | |
| D. | 达到平衡时,SO2和SO3的浓度一定相等 |
 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验: 乳酸(
乳酸(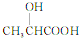 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.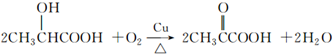 .
.