题目内容
20.下列反应既能属于氧化还原反应,又属于吸热反应的是( )| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
分析 存在元素的化合价变化的反应为氧化还原反应,常见的吸热反应有:Ba(OH)2•8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,以此来解答.
解答 解:A.为放热反应,Al、H元素的化合价变化,属于氧化还原反应,故A不选;
B.为吸热反应,但没有元素的化合价变化,不属于氧化还原反应,故B不选;
C.为吸热反应,且C元素的化合价变化,属于氧化还原反应,故C选;
D.为放热反应,属于氧化还原反应,故D不选,
故选C.
点评 本题考查氧化还原反应,侧重反应类型判断的考查,注意化合价角度及归纳常见的吸热反应分析,题目难度不大.

练习册系列答案
相关题目
8.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)Y在元素周期表中的位置是第三周期第ⅥA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.(用元素符号表示)
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
15.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
5.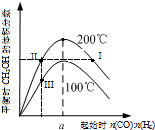 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
9.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
10.设阿伏加德罗常数为 NA,则下列说法正确的是( )
| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
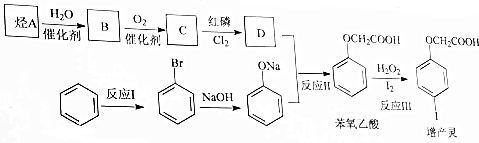
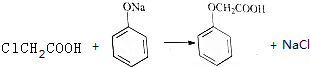 .
. 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验: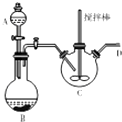 乳酸(
乳酸(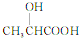 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.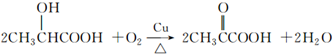 .
.