题目内容
18.标准状况下 1.68L 无色可燃气体在足量氧气中完全燃烧.若将产物全部通入足量澄清石灰水,得到的白色沉淀 15.0g;若用足量碱石灰吸收所有燃烧产物,装碱石灰的干燥管增重 9.3g.若该气体由两种等物质的量的气体组成.则该气体的成分可能是( )| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
分析 碳酸钙物质的量为$\frac{15.0g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,结合选项判断.
解答 解:碳酸钙物质的量为$\frac{15.0g}{100g/mol}$=0.15mol,则n(CO2)=n(CaCO3)=0.15mol,m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,无色可燃气体A、B总物质的量=$\frac{1.68L}{22.4L/mol}$=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,故该混合气体平均分子式为C2H4或C2H4Ox,
A.C3H4和 H2等物质的量混合,平均分子式为C1.5H3,不符合题意,故A错误;
B.C3H8和 CO等物质的量混合,平均分子式为C2H4,符合题意,故B正确;
C.CH4和 C3H4等物质的量混合,平均分子式为C2H4,符合题意,故C正确;
D.C3H6和 CO2等物质的量混合,平均分子式为C2H3O0.5,不符合题意,故D错误;
故选BC.
点评 本题考查有机物分子式确定的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.

 作业辅导系列答案
作业辅导系列答案| A. | 200mL | B. | 500 mL | C. | 250 mL | D. | 100 mL |
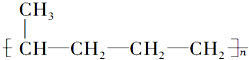 的是( )
的是( )| A. | CH3CH═CH2和CH4 | B. | 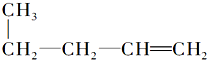 | ||
| C. | CH3CH═CH2和CH4═CH2 | D. | 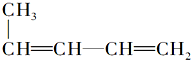 |
| A. | NO2的反应速率与NO的反应速率相等 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 单位时间内生成n molO2的同时生成2nmolNO |
| A. | 元素的原子序数等于核电荷数 | |
| B. | 元素原子的质子数等于核外电子数 | |
| C. | 元素所在周期序数等于该元素原子的最外层电子数 | |
| D. | 元素所在周期序数等于该元素原子的电子层数 |
| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
 .
.