题目内容
7.下列说法中不正确的是( )| A. | 元素的原子序数等于核电荷数 | |
| B. | 元素原子的质子数等于核外电子数 | |
| C. | 元素所在周期序数等于该元素原子的最外层电子数 | |
| D. | 元素所在周期序数等于该元素原子的电子层数 |
分析 A、在原子中质子数=核电荷数=核电荷数;
B、原子呈电中性,质子数等于核外电子数;
C、周期表中,主族元素的族序数等于最外层电子数;
D、周期表中,原子核外电子层数等于周期数;
解答 解:A、在原子中质子数=核电荷数=核电荷数,所以元素的原子序数等于核电荷数,故A正确;
B、原子呈电中性,质子数等于核外电子数,故B正确;
C、周期表中,主族元素的族序数等于最外层电子数,则周期序数等于该元素原子核外电子层数,故C错误;
D、周期表中,原子核外电子层数等于周期数,故D正确;
故选C.
点评 本题综合考查元素周期表与周期律知识,为高频考点和常见题型,注意把握元素周期表的构成以及原子的核外电子排布特点,难度不大.

练习册系列答案
相关题目
17.某烃的衍生物分子式可写成(CH2)m(CO2)n(H2O)m,当它完全燃烧时,生成的CO2与消耗的O2在同温同压下体积比为1:1,则m、n的比值为( )
| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 2:1 |
18.标准状况下 1.68L 无色可燃气体在足量氧气中完全燃烧.若将产物全部通入足量澄清石灰水,得到的白色沉淀 15.0g;若用足量碱石灰吸收所有燃烧产物,装碱石灰的干燥管增重 9.3g.若该气体由两种等物质的量的气体组成.则该气体的成分可能是( )
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
15.下列说法正确的是( )
| A. | 天然橡胶分子中含有碳碳双键,能发生加成反应 | |
| B. | 硫化橡胶遇汽油能发生溶胀现象 | |
| C. | 聚硫橡胶具有良好的耐严寒,耐高温性能 | |
| D. | 合成橡胶是以石油、天然气为原料,以二烯烃和烯烃为单体聚合而成分高分子 |
2.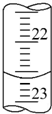 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ,该错误操作会导致测定结果偏大
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化,判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
①a的读数如图所示,则a=22.60;
②烧碱样品的纯度为80.8%.
 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ,该错误操作会导致测定结果偏大
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化,判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
②烧碱样品的纯度为80.8%.
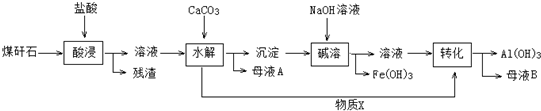
9.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
6.下列电离方程式中,不正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Al2(SO4)3═3SO42-+2Al3+ |

 .
. ,其名称为3-乙基戊烷.
,其名称为3-乙基戊烷.