题目内容
18.下列有关化学用语表示正确的是( )| A. | H2O2的电子式: | |
| B. | 铝离子的结构示意图: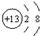 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
分析 A、双氧水为共价化合物;
B、铝离子是铝原子失去三个电子形成的;
C、质量数=质子数+中子数;
D、由同种元素形成的不同单质互为同素异形体.
解答 解:A、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故A错误;
,故A错误;
B、铝离子是铝原子失去三个电子形成的,故铝离子的结构示意图为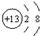 ,故B正确;
,故B正确;
C、质量数=质子数+中子数,故质子数为35、中子数为45的溴原子的质量数为80,故符号为8035Br,故C错误;
D、由同种元素形成的不同单质互为同素异形体,而146C与126C均为碳原子,不是单质,故不是同素异形体,故D错误.
故选B.
点评 本题考查了常见的化学用语,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
18.标准状况下 1.68L 无色可燃气体在足量氧气中完全燃烧.若将产物全部通入足量澄清石灰水,得到的白色沉淀 15.0g;若用足量碱石灰吸收所有燃烧产物,装碱石灰的干燥管增重 9.3g.若该气体由两种等物质的量的气体组成.则该气体的成分可能是( )
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
9.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
6.下列电离方程式中,不正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Al2(SO4)3═3SO42-+2Al3+ |
10. 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
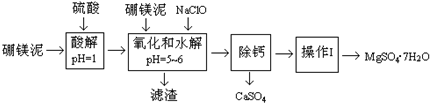
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
(5)硫酸镁分解生成的SO2经如图的两个循环可分别得到S和H2SO4.写出循环Ⅰ中反应2的化学方程式为4ZnFeO3.5+SO2$\frac{\underline{\;△\;}}{\;}$4ZnFeO4+S;循环Ⅱ中电解过程阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
 、
、 .
.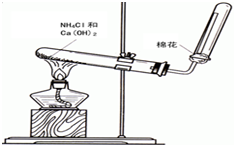 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.

 .
. ,其名称为3-乙基戊烷.
,其名称为3-乙基戊烷.
 ;
; .
.