题目内容
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
考点:铜金属及其重要化合物的主要性质,碱金属的性质,焰色反应,试纸的使用
专题:元素及其化合物
分析:A、铜在常温下,难与空气中的氧气反应,加热时可与氧气反应,不能说明铜与氧气的反应属于吸热反应;
B、金属锂与氧气反应只有一种产物氧化锂:Li2O;
C、焰色反应中的铂丝用稀盐酸洗涤;
D、氯水具有漂白性,据此解答即可.
B、金属锂与氧气反应只有一种产物氧化锂:Li2O;
C、焰色反应中的铂丝用稀盐酸洗涤;
D、氯水具有漂白性,据此解答即可.
解答:
解:A、铜与氧气的反应需要加热,不能说明铜与氧气的反应属于吸热反应,故A错误;
B、锂与氧气只能生成氧化锂,故B错误;
C、焰色反应实验之后,用盐酸除去其它元素杂质,因为盐酸挥发性强,故不会残留盐酸杂质,C正确;
D、氯水具有漂白性,故不能用pH试纸测量氯水的pH值,故D错误;
故选择C.
B、锂与氧气只能生成氧化锂,故B错误;
C、焰色反应实验之后,用盐酸除去其它元素杂质,因为盐酸挥发性强,故不会残留盐酸杂质,C正确;
D、氯水具有漂白性,故不能用pH试纸测量氯水的pH值,故D错误;
故选择C.
点评:本题主要考查了反应热、碱金属的性质、焰色反应实验和氯水的漂白性,综合性较强,但是难度不大,属于好题.

练习册系列答案
相关题目
下列粒子中,电子排布式为1s22s22p63s23p6的有( )
| A、Sc3+ |
| B、Mg2+ |
| C、Cl- |
| D、Br- |
核电荷数为15的原子,n层电子个数最多,n层为( )
| A、K层 | B、N层 | C、M层 | D、L层 |
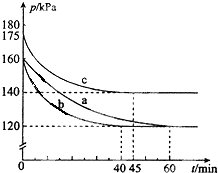 化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
化合物PCl3和单质Cl2在一定条件下反应可生成化合物PCl5.回答下列问题:
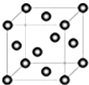 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.