题目内容
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol?L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示).
(2)实验室制备氨气的化学方程式为 .工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应.以石墨为电极,将该反应设计成原电池,该电池的负极反应为 .
(3)在3L密闭容器中,起始投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量.
①则T1 T2(填“>”、“<”或“=”)
②在T2K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= .若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)
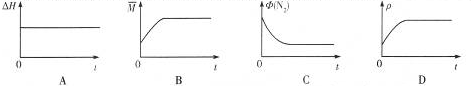
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
)、N2体积分数Φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 .
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
(2)实验室制备氨气的化学方程式为
(3)在3L密闭容器中,起始投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1
②在T2K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量(
. |
| M |

考点:难溶电解质的溶解平衡及沉淀转化的本质,反应热和焓变,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)根据各物质的溶度积常数计算出开始沉淀时溶液中氢氧根离子的浓度,再判断;
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气;原电池中N2H4失电子,在负极上反应;
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,根据温度对平衡的影响分析;
②根据生成的氨气的量求出氢气的浓度变化量,再求反应速率;N2的转化率α(N2)=
×100%;根据影响K的因素分析;
③反应达到平衡状态时,同一物质的正逆反应速率相等,平衡时各种物质的物质的量浓度、百分含量等不再发生变化,以及由此衍生的一些量也不发生变化,说明可逆反应到达平衡状态,结合图象分析.
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气;原电池中N2H4失电子,在负极上反应;
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,根据温度对平衡的影响分析;
②根据生成的氨气的量求出氢气的浓度变化量,再求反应速率;N2的转化率α(N2)=
| n(转化的氮气的量) |
| n(氮气的初始量) |
③反应达到平衡状态时,同一物质的正逆反应速率相等,平衡时各种物质的物质的量浓度、百分含量等不再发生变化,以及由此衍生的一些量也不发生变化,说明可逆反应到达平衡状态,结合图象分析.
解答:
解:(1)向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol?L-1的溶液中缓慢滴加稀氨水,
开始生成Cu(OH)2沉淀时,c(OH-)=
=
=
×10-9mol?L-1,
开始生成Fe(OH)3沉淀时,c(OH-)=
=
×10-12mol?L-1,
开始生成Fe(OH)2沉淀时,c(OH-)=
=
×10-7mol?L-1,
开始生成Mg(OH)2沉淀时,c(OH-)=
=
×10-5mol?L-1,
开始生成沉淀时溶液中氢氧根离子浓度越小,则该物质越容易沉淀,所以产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
故答案为:Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气,氯化铵和氢氧化钙反应生成氨气、氯化钙和水,其反应的方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;原电池中NH3失电子,在负极上反应生成N2H4,其负极的电极反应式为:2NH3+2OH--2e-═N2H4+2H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;2NH3+2OH--2e-═N2H4+2H2O;
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,升高温度平衡逆向移动,氨气的物质的量减小,已知T1时氨气的物质的量大,说明T1时温度低,则T1<T2;
故答案为:<;
②在T2K下,经过10min达到化学平衡状态,平衡时氨气的物质的量为2mol,则反应的氢气为2mol×
=3mol,v=
=
=0.1 mol?L-1?min-1;N2的转化率α(N2)=
×100%=
×100%=25%;该反应的平衡常数只与温度有关,再增加氢气浓度,反应的平衡常数将不变;
故答案为:0.1 mol?L-1?min-1; 25%;不变;
③A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC.
开始生成Cu(OH)2沉淀时,c(OH-)=
|
|
| 2.2 |
开始生成Fe(OH)3沉淀时,c(OH-)=
| 3 |
| ||
| 3 | 4 |
开始生成Fe(OH)2沉淀时,c(OH-)=
|
| 8 |
开始生成Mg(OH)2沉淀时,c(OH-)=
|
| 18 |
开始生成沉淀时溶液中氢氧根离子浓度越小,则该物质越容易沉淀,所以产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
故答案为:Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2;
(2)实验室用加热氯化铵和氢氧化钙固体混合物来制备氨气,氯化铵和氢氧化钙反应生成氨气、氯化钙和水,其反应的方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(3)①破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量,则该反应为放热反应,升高温度平衡逆向移动,氨气的物质的量减小,已知T1时氨气的物质的量大,说明T1时温度低,则T1<T2;
故答案为:<;
②在T2K下,经过10min达到化学平衡状态,平衡时氨气的物质的量为2mol,则反应的氢气为2mol×
| 3 |
| 2 |
| ||
| t |
| ||
| 10min |
| n(转化的氮气的量) |
| n(氮气的初始量) |
2mol×
| ||
| 4mol |
故答案为:0.1 mol?L-1?min-1; 25%;不变;
③A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC.
点评:本题考查了溶度积常数的应用、原电池原理、化学平衡状态的判断、反应速率的计算等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等,注意把握溶度积的含义和公式应用、电极方程式的书写、化学平衡的有关计算.

练习册系列答案
相关题目
下列物质的颜色是白色的是( )
| A、Cu2O |
| B、CuO |
| C、CuSO4 |
| D、Na2O2 |
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13mol?L-1的溶液中,Ca2+、K4、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp=6.82x10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 |
| C、对于反应N2H4(l)=N2(g)+2H2(g);△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2mol?L-1某一元碱(ROH)溶液和0.1mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
将等质量的铜丝在酒精灯上加热后,分别插入下列物质中,放置片刻,铜丝质量增大的是( )
| A、硝酸 | B、无水乙醇 |
| C、氯化钠溶液 | D、盐酸 |
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
 根据如图回答问题:
根据如图回答问题: