题目内容
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.(1)Cu属于
(2)与OH-互为等电子体的一种分子为
(3)醛基中碳原子的轨道杂化类型是
(4)将氨气通入到Cu(OH)2悬浊液的离子方程式为
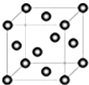
(5)Cu2O在稀硫酸中生成Cu和CuSO4.铜晶胞结构如图所示,铜晶体中每个铜原子周围等距离且最近的铜原子数目为
(6)已知Cu的相对原子质量为M,原子半径为a pm,阿伏加德罗常数为NA(mol-1),则Cu的密度为
考点:晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
(2)原子个数相等、价电子数相等的微粒互为等电子体,等电子体的结构相似;
(3)根据价层电子对互斥理论确定原子杂化方式,一个乙醛分子中含有6个σ键;
(4)将氨气通入到Cu(OH)2悬浊液生成银氨离子;
(5)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×
;
(6)根据均摊法计算出晶胞中原子数目,再根据密度计算公式ρ=
可解.
(2)原子个数相等、价电子数相等的微粒互为等电子体,等电子体的结构相似;
(3)根据价层电子对互斥理论确定原子杂化方式,一个乙醛分子中含有6个σ键;
(4)将氨气通入到Cu(OH)2悬浊液生成银氨离子;
(5)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×
| 1 |
| 2 |
(6)根据均摊法计算出晶胞中原子数目,再根据密度计算公式ρ=
| m |
| V |
解答:
解:(1)Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,故价电子排布式为3d10 ,所以Cu属于ds区元素;
故答案为:ds;3d10 ;
(2)原子个数相等、价电子数相等的微粒互为等电子体,与OH-互为等电子体的一种分子为HF,故答案为:HF;
(3)醛基中碳原子含有3个σ键,所以醛基中碳原子的轨道杂化类型是sp2,一个乙醛分子中含有6个σ键,所以1mol乙醛分子中含有的σ键的数目为6mol或6×6.02×1023个;
故答案为:sp2;6mol或6×6.02×1023个;
(4)将氨气通入到Cu(OH)2悬浊液生成银氨离子,反应的离子方程式为Cu(OH)2+4NH3═〔Cu(NH3)4〕2++2OH-;
故答案为:Cu(OH)2+4NH3═〔Cu(NH3)4〕2++2OH-;
(5)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×
=12;
故答案为:12;
(6)根据均摊法计晶胞中Cu原子数=8×
+6×
=4,每个晶胞质量
每个晶胞体积v=(a×4×10-10)3cm3,则Cu的密度ρ=
=
=
g?cm-3,故答案为:
.
故答案为:ds;3d10 ;
(2)原子个数相等、价电子数相等的微粒互为等电子体,与OH-互为等电子体的一种分子为HF,故答案为:HF;
(3)醛基中碳原子含有3个σ键,所以醛基中碳原子的轨道杂化类型是sp2,一个乙醛分子中含有6个σ键,所以1mol乙醛分子中含有的σ键的数目为6mol或6×6.02×1023个;
故答案为:sp2;6mol或6×6.02×1023个;
(4)将氨气通入到Cu(OH)2悬浊液生成银氨离子,反应的离子方程式为Cu(OH)2+4NH3═〔Cu(NH3)4〕2++2OH-;
故答案为:Cu(OH)2+4NH3═〔Cu(NH3)4〕2++2OH-;
(5)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×
| 1 |
| 2 |
故答案为:12;
(6)根据均摊法计晶胞中Cu原子数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| (a×4×10-10)3cm3 |
| m |
| v |
| ||
| (a×4×10-10)3cm3 |
| 4M |
| NA(4a×10-10)3 |
| 4M |
| NA(4a×10-10)3 |
点评:本题考查了物质结构与性质的有关知识,涉及配位数的计算、原子杂化方式的判断、核外电子排布式的书写等知识点,根据构造原理、价层电子对互斥理论等知识点来分析解答,题目难度较大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、用pH试纸测得某浓度氯水的pH为4 |
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A、根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
| C、到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
 1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、1-丁醇和乙酸能反应完或者有一种能消耗完 |
| D、为了提高反应速率,所以要加入浓硫酸做催化剂并加热 |
下列实验能获得成功的是( )

| A、用如图所示装置,只用无水乙酸和乙醇共热就能制取乙酸乙酯 |
| B、将苯逐滴滴入浓溴水中,充分反应后就能制取溴苯 |
| C、将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 |
| D、将苯逐滴滴入酸性高锰酸钾溶液中,溶液最终褪成无色 |
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:

