题目内容
18.冰晶石(Na3AlF6,微溶于水)可作工业电解铝的助溶剂,以氟硅酸钠为原料制备冰晶石的工艺流程如图所示: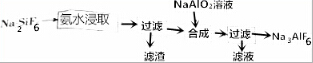
(1)氨水浸取氟硅酸钠时生成两种氟盐和两种氧化物,该反应的化学方程式为Na2SiF6+4NH3•H2O=2NaF+4NH4F+SiO2+2H2O.
(2)第一次过滤所得滤渣的成分为SiO2(填化学式).
(3)NaAlO2溶液可以铝土矿(主要成分为Al2O3)为原料制取,制取反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)第二次过滤所得滤液的适宜用途是可循环使用.
(5)LiAlH4是工业上常用的还原剂,它可由LiH和AlCl3在热乙醚中合成,该合成反应的化学方程式为AlCl3+4LiH $\frac{\underline{\;乙醚\;}}{\;}$LiAlH4+3LiCl.
分析 氨水浸取氟硅酸钠时生成两种氟盐和两种氧化物,应分别生成NaF、NH4F、SiO2和H2O,过滤得到的滤渣为SiO2,在滤液中加入NaAlO2溶液得到Na3AlF6,滤液为氨气水溶液,可循环使用,以此解答该题.
解答 解:氨水浸取氟硅酸钠时生成两种氟盐和两种氧化物,应分别生成NaF、NH4F、SiO2和H2O,过滤得到的滤渣为SiO2,在滤液中加入NaAlO2溶液得到Na3AlF6,滤液为氨气水溶液,可循环使用,
(1)氨水浸取氟硅酸钠时生成两种氟盐和两种氧化物,应分别生成NaF、NH4F、SiO2和H2O,方程式为Na2SiF6+4NH3•H2O=2NaF+4NH4F+SiO2+2H2O,
故答案为:Na2SiF6+4NH3•H2O=2NaF+4NH4F+SiO2+2H2O;
(2)由以上分析可知第一次过滤所得滤渣的成分为SiO2,故答案为:SiO2;
(3)氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)滤液为氨气水溶液,可循环使用,故答案为:可循环使用;
(5)反应的方程式为AlCl3+4LiH $\frac{\underline{\;乙醚\;}}{\;}$LiAlH4+3LiCl,故答案为:AlCl3+4LiH $\frac{\underline{\;乙醚\;}}{\;}$LiAlH4+3LiCl.
点评 本题考查化学工艺流程、无机物推断等,题目难度中等,理解工艺流程是解题的关键,题中物质的制备是中学中比较陌生的知识,是难点、易错点,需要学生基本扎实的据此与运用知识分析解决问题的能力.

练习册系列答案
相关题目
3.下列说法的是( )
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | SO3晶体属于原子晶体 | |
| C. | 1molSiO2晶体中含有2molSi-O键 | |
| D. | 金刚石化学性质稳定,即使高温下也不会和O2反应 |
10.下列说法正确的是( )
| A. | 含磷洗涤剂中的Na5P3O10中磷的化合价为+7价 | |
| B. | 有多少种元素就一定有多少种单质 | |
| C. | 金刚石、石墨和C60全部以游离态存在 | |
| D. | 含多种元素的物质一定是混合物 |
11.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n,下列说法错误的是( )
| A. | 若8>m>3,则X必定为主族元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为极性分子 | |
| C. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
12. 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )| A. | 反应一段时间,①中试管底部有少量固体生成 | |
| B. | ②中用品红溶液验证SO2的生成 | |
| C. | ③中用石蕊溶液检验SO2溶液的酸碱性 | |
| D. | 向①中直接加水,观察颜色,确认CuSO4生成 |
 实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:

 ,物质D中含有的官能团的名称为羧基.
,物质D中含有的官能团的名称为羧基. ;
; );
);