题目内容
12. 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列有关实验的说法不合理的是( )| A. | 反应一段时间,①中试管底部有少量固体生成 | |
| B. | ②中用品红溶液验证SO2的生成 | |
| C. | ③中用石蕊溶液检验SO2溶液的酸碱性 | |
| D. | 向①中直接加水,观察颜色,确认CuSO4生成 |
分析 A.铜与浓硫酸在加热条件下生成硫酸铜,浓硫酸具有吸水性;
B.二氧化硫具有漂白性;
C.SO2为酸性气体,可与水发生反应生成亚硫酸,溶液显酸性;
D.①中生成硫酸铜溶液,不需要加水.
解答 解:A.浓硫酸是过量的,反应生成的少量硫酸铜溶液,但浓硫酸有吸水性,所以试管①底部有少量蓝色固体(硫酸铜晶体)或少量白色固体(无水硫酸铜)存在,则A选项正确;
B.二氧化硫具有漂白性,能够使品红褪色,故B正确;
C.SO2为酸性气体,可与水发生反应生成亚硫酸,溶液显酸性,石蕊变红色,故C正确;
D.浓硫酸过量,不能直接加水,故D错误;
故选:D.
点评 本题考查二氧化硫的制备和性质,题目难度不大,熟悉二氧化硫的性质是解题关键,注意对基础知识的巩固.

练习册系列答案
相关题目
7.“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式.下列不符合“低碳生活”的做法是( )
| A. | 自驾车代替骑自行车出行 | B. | 环保袋代替一次性塑料袋 | ||
| C. | 太阳能热水器代替燃气热水器 | D. | 节能灯代替白炽灯 |
2.二氯化二硫(S2C12)的结构式为Cl-S-S-Cl,易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓.对该反应下列说法正确的是( )
| A. | S2C12做氧化剂,H2O做还原剂 | |
| B. | 氧化产物与还原产物的物质的量之比为l:3 | |
| C. | 每生成l mol SO2转移4 mol电子 | |
| D. | 每生成48g硫会断裂6mol共价键 |
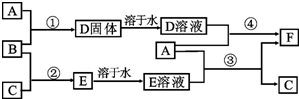 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.