题目内容
9.已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟.A、B、C、D、E、F间有如下变化关系: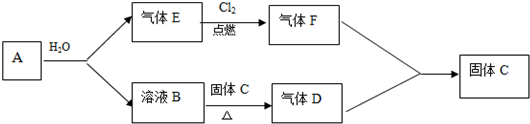
(1)A的名称是钠;F的化学式是HCl.
(2)写出A与水反应的离子方程式2Na+2H2O=2 Na++2OH-+H2↑
(3)B→D反应的化学方程式为NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
(4)写出气体E在氯气中反应的现象安静的燃烧,苍白色火焰,瓶口有白雾.
分析 A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,且焰色反应呈黄色,说明含有钠元素,所以A为Na、B是NaOH、E是H2.氢气在氯气中燃烧生成F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,据此解答.
解答 解:A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,且焰色反应呈黄色,说明含有钠元素,所以A为Na、B是NaOH、E是H2.氢气在氯气中燃烧生成F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl.
(1)A的名称是钠,F的化学式是HCl,故答案为:Na;HCl;
(2)A与水反应的离子方程式:2Na+2H2O=2 Na++2OH-+H2↑,
故答案为:2Na+2H2O=2 Na++2OH-+H2↑;
(3)B→D反应的化学方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O,
故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O;
(4)氢气在氯气中反应的现象:安静的燃烧,苍白色火焰,瓶口有白雾,
故答案为:安静的燃烧,苍白色火焰,瓶口有白雾.
点评 本题考查无机物的推断,B溶液性质及焰色反应、D与F反应现象等为推断突破口,注意对元素化合物性质的掌握.

练习册系列答案
相关题目
19.下列关于浓硫酸和浓硝酸的叙述正确的是( )
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
20.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |
17.已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示(已知CuO 可以作为碳氢化合物燃烧的催化剂):

(1)若A装置中所盛放的药品是浓NaOH 溶液,装置A的作用有:
①除去空气中的CO2气体;
②调节X和空气的通入速率,保证O2过量
(2)D装置中所盛放的药品是浓NaOH溶液,
(3)E装置的作用是防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响,
(4)上述装置中有一处缺陷,请改正在A、B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管.
(5)若实验装置经过改正后,得到的实验数据如下:
则该气体中碳和氢两种元素的质量比为3:1.

(1)若A装置中所盛放的药品是浓NaOH 溶液,装置A的作用有:
①除去空气中的CO2气体;
②调节X和空气的通入速率,保证O2过量
(2)D装置中所盛放的药品是浓NaOH溶液,
(3)E装置的作用是防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响,
(4)上述装置中有一处缺陷,请改正在A、B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管.
(5)若实验装置经过改正后,得到的实验数据如下:
| 质量 | 实验前 | 实验后 |
| 药品+U形管的质量/g | 101.1 | 102.9 |
| 药品+广口瓶D的质量/g | 312.0 | 314.2 |
4.下列离子方程式书写正确的是( )
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钠溶液与硫酸铜溶液反应 2OH-+Cu2+═Cu(OH)2↓ |
14.肼(N2H4)是一种重要的工业产品.资料表明,氨和次氯酸钠溶液反应能生成肼.相关物质的物理性质如下:
某学生对NH3与NaClO的反应进行实验探究:
(1)NaClO溶液呈碱性的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 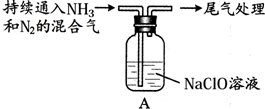 | 液面上方出现白雾 |
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
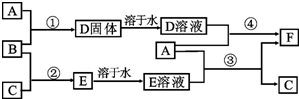 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.