题目内容
3.下列说法的是( )| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | SO3晶体属于原子晶体 | |
| C. | 1molSiO2晶体中含有2molSi-O键 | |
| D. | 金刚石化学性质稳定,即使高温下也不会和O2反应 |
分析 A.金刚石网状结构中,最小的环上有6个碳原子;
B.常见的由分子构成的物质有:非金属单质(C、Si等除外),非金属氢化物,非金属氧化物(二氧化硅等除外)、酸、有机物(有机酸盐等除外)等;
C.二氧化硅晶体中Si与4个O成键;
D.金刚石属于碳单质,在高温下可以和O2反应.
解答 解:A.由金刚石晶体结构知,最小碳环是6个碳原子构成的六元环,故A正确;
B.SO3是由分子构成,属于分子晶体,故B错误;
C.二氧化硅晶体中Si与4个O成键,则1molSiO2晶体中含有4molSi-O键,故C错误;
D.金刚石化学性质稳定,但在高温下会和O2反应,故D错误.
故选A.
点评 本题考查化学键计算、物质结构与性质等知识点,侧重考查学生空间想象能力及判断能力,易错选项是A.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
13.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O,c(NH4+)由大到小的顺序是:④>③>②>① | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
14.肼(N2H4)是一种重要的工业产品.资料表明,氨和次氯酸钠溶液反应能生成肼.相关物质的物理性质如下:
某学生对NH3与NaClO的反应进行实验探究:
(1)NaClO溶液呈碱性的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 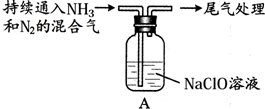 | 液面上方出现白雾 |
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
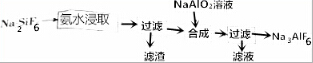
11.高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为3:1.
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应Ⅰ的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
②反应Ⅱ的化学方程式为3NaClO+10NaOH+2Fe(NO3)3=2Na2FeO4+3NaCl+6NaNO3+5H2O.
③加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为,它能净水的原因是高铁酸钾有强氧化性,高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性使水澄清.
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①反应Ⅰ的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
②反应Ⅱ的化学方程式为3NaClO+10NaOH+2Fe(NO3)3=2Na2FeO4+3NaCl+6NaNO3+5H2O.
③加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为,它能净水的原因是高铁酸钾有强氧化性,高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性使水澄清.
8.下列离子方程式不正确的是( )
| A. | 向NaClO溶液中滴入少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O | |
| B. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | Na2SO3溶液中SO32-的水解:SO32-+H2O$\frac{\underline{\;电解\;}}{\;}$HSO3-+OH- |
15.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 | |
| B. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
16.已知蓄电池在放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应方程式可用下列式表示Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O 据此判断下列叙述中正确的是( )
| A. | 放电时铅蓄电池负极电池反应 PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 充电时蓄电池阴极电极反应 PbSO4+2e-═Pb+SO42- | |
| C. | 用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.025mol H2SO4 | |
| D. | 铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子 |