题目内容
10.ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛?某兴趣小组通过图1装置(夹持装置略)对其制备?吸收?释放和应用进行了研究?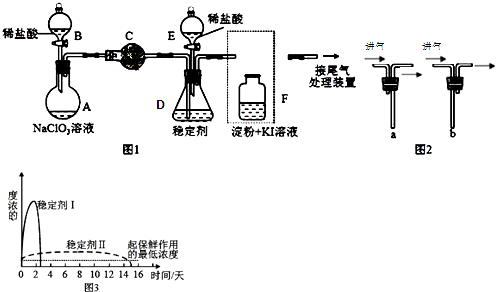
(1)仪器C的名称是:球形干燥管?安装F中导管时,应选用图2中的:b(填“a”或“b”)
(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;为使ClO2在D中被稳定剂充分吸收,可采取的措施是调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度?
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是:吸收Cl2.
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:4H++5ClO2?═Cl?+4ClO2↑+2H2O,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是:检验是否有ClO2生成?
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂的保鲜原因是:稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度?
分析 (1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气;
(2)根据电子转移守恒和原子守恒书写氯酸钠和稀盐酸混和产生Cl2和ClO2的反应化学方程式,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:球形干燥管;b;
(2)氯酸钠和稀盐酸混和产生Cl2和ClO2,NaClO3中氯为+5价被还原成ClO2中+4价,盐酸中氯为-1价,被氧化成0价氯,转移电子数为2,所以NaClO3、ClO2前系数为2,Cl2前系数为1,反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,:为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,即调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度,
故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;检验是否有ClO2生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.

| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
| A. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| B. | 一个化学反应是吸热还是放热,取决于反应物和生成物总能量的相对大小 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| A. | 金属钠着火时,立即用沾水的毛巾覆盖 | |
| B. | 将含有硫酸的废液倒人水池,用大量水冲人下水道 | |
| C. | 锌和稀硫酸反应生成的氢气可直接点燃,观察火焰的颜色 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 |
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 铁器(植物油) | 热纯碱溶液 | 洗涤 |
| B | BaCO3(BaSO${\;}_{{4}_{\;}}$) | 饱和碳酸钠溶液 | 搅拌、过滤 |
| C | KNO3(NaCl) | 水 | 蒸发结晶 |
| D | HCl(Cl2) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |