题目内容
14.同温同压下,等体积的CO和CH4分别在足量的氧气中完全燃烧,消耗O2体积分别为xL和yL,则x与y的比值为( )| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
分析 依据二者发生的反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,令CO和CH4的体积均为2L,根据方程式计算消耗氧气的体积.
解答 解:令CO和CH4的体积均为2L,依据方程式:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2可知2L一氧化碳完全燃烧消耗氧气1L,依据方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O可知,2L甲烷完全燃烧消耗氧气为4L,则二者消耗氧气的体积之比为:1:4;
故选:D.
点评 本题考查化学方程式有关计算,明确发生的反应即可解答,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.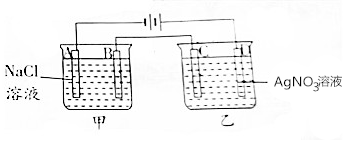 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).
电极反应式:
A极:2H++2e-═H2↑;
B极:2Cl--2e-=Cl2↑;
C极:Ag++e-═Ag;
D极:4OH--4e-═2H2O+O2↑.
 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).电极反应式:
A极:2H++2e-═H2↑;
B极:2Cl--2e-=Cl2↑;
C极:Ag++e-═Ag;
D极:4OH--4e-═2H2O+O2↑.
18.如图所示装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是( )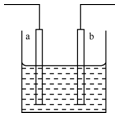

| A. | a,b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硝酸 | |
| C. | 该装置可能是原电池,电解质溶液为稀盐酸 | |
| D. | 该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 |
2.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 偏铝酸钠溶液:K+、NO3-、NH3•H2O | |
| B. | 空气:C2H6、CO2、SO2、NO | |
| C. | 硫酸铜溶液:H+、K+、S2-、Br- | |
| D. | 重铬酸钾钾溶液:H+、Na+、SO42-、乙醛分子 |
9.如图表示初中化学常见实验操作,其中正确的是( )
| A. |  点燃酒精灯 | B. |  检查装置的气密性 | ||
| C. |  读出液体的体积 | D. |  液体的取用 |
19.下列关于同温同压下的两种气体CH4和O2的判断正确的是( )
| A. | 体积相等时密度之比为2:1 | |
| B. | 原子数相等时具有的电子数之比为1:4 | |
| C. | 质量相等时具有的质子数之比为4:5 | |
| D. | 体积相等时具有的原子数之比为1:2 |
4.下列说法正确的是( )
| A. | 25℃、101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 化石燃料在任何条件下都能充分燃烧 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 弱酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
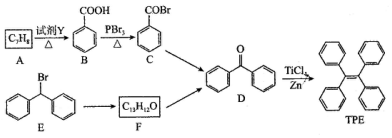
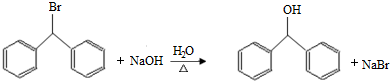 .
. )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式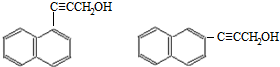 .
.