题目内容
3.(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3:C(s)+CO2(g)?2CO(g) K1
CO(g)+H2O(g)?CO2(g)+H2(g) K2
C(s)+H2O(g)?CO(g)+H2(g) K3
则K1、K2、K3之间的关系是K3=K1×K2
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计)9:1.
分析 (1)由①C(s)+CO2(g)?2CO(g) K1
②CO(g)+H2O(g)?CO2(g)+H2(g) K2
结合盖斯定律可知,①+②得到C(s)+H2O(g)?CO(g)+H2(g);
(2)25℃时Kw=10-14,溶液pH=10,可知碱过量,设酸的体积为x,强碱体积为y,则$\frac{0.01mol/L×x-y×0.001mol/L}{x+y}$=10-4mol/L.
解答 解:(1)由①C(s)+CO2(g)?2CO(g) K1
②CO(g)+H2O(g)?CO2(g)+H2(g) K2
结合盖斯定律可知,①+②得到C(s)+H2O(g)?CO(g)+H2(g),则K3=K1×K2,
故答案为:K1×K2;
(2)25℃时Kw=10-14,溶液pH=10,可知碱过量,设酸的体积为x,强碱体积为y,则$\frac{0.01mol/L×x-y×0.001mol/L}{x+y}$=10-4mol/L,
解得x:y=9:1,
故答案为:9:1.
点评 本题考查化学平衡的计算,为高频考点,把握K与化学计量数的关系、酸碱混合的计算为解答的关键,侧重分析与计算能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14.同温同压下,等体积的CO和CH4分别在足量的氧气中完全燃烧,消耗O2体积分别为xL和yL,则x与y的比值为( )
| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
18.分子式为C4H10O的有机物,能与钠反应放出H2的有( )种.
| A. | 4 | B. | 6 | C. | 7 | D. | 8 |
8.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
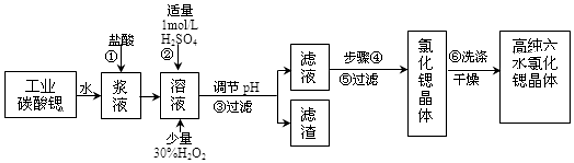
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.
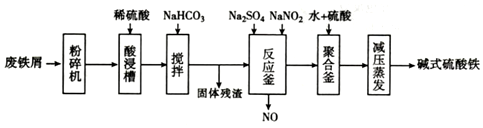
15.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.




 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$
 ;
; +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$ +2HCl;
+2HCl; 、
、 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.