题目内容
17.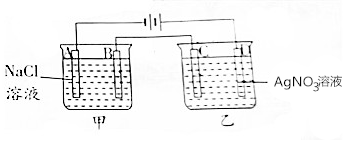 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).电极反应式:
A极:2H++2e-═H2↑;
B极:2Cl--2e-=Cl2↑;
C极:Ag++e-═Ag;
D极:4OH--4e-═2H2O+O2↑.
分析 左、右两个装置都是电解池,左侧装置,A连接电源的负极,为阴极,发生还原反应,H+放电生成H2,B为阳极,发生氧化反应,Cl-放电生成Cl2,右侧装置,C为阴极,发生还原反应,Ag+放电生成Ag,D连接电源的正极,为阳极,发生氧化反应,氢氧根离子放电生成O2,以此解答该题.
解答 解:左、右两个装置都是电解池,左侧装置,A连接电源的负极,为阴极,发生还原反应,H+放电生成H2,即:2H++2e-═H2↑,B为阳极,发生氧化反应,Cl-放电生成Cl2,右侧装置,C为阴极,发生还原反应,Ag+放电生成Ag,4Ag++4e-═4Ag,D连接电源的正极,为阳极,发生氧化反应,氢氧根离子放电生成O2,4OH--4e-═2H2O+O2↑,
故答案为:2H++2e-═H2↑;2Cl--2e-=Cl2↑;Ag++e-═Ag;4OH--4e-═2H2O+O2↑.
点评 本题考查电解原理以及电极反应式的书写知识,为高频考点,侧重考查学生的分析能力,注意把握离子的放电顺序,为解答该题的关键,难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
7.
| 物质 | 分子数 | 质量(g) | 物质的量(mol) | 摩尔质量(g•mol-1) |
| N2 | 3.01×1023 | |||
| CO2 | 4.4 | |||
| HCl | 0.5 | |||
| H2SO4 | 49 |
8.现代以石油化工为基础的三大合成材料是( )
①塑料 ②合成氨 ③合成盐酸 ④合成橡胶 ⑤合成纤维 ⑥合成尿素 ⑦合成洗涤剂.
①塑料 ②合成氨 ③合成盐酸 ④合成橡胶 ⑤合成纤维 ⑥合成尿素 ⑦合成洗涤剂.
| A. | ②④⑦ | B. | ①②⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
5.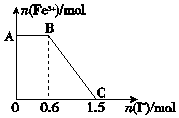 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.15 mol | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:6 |
12.除去下列物质中的杂质(括号内为杂质),选用的试剂(空白表示不选试剂)及主要操作方法均合理的一组是
( )
| 选项 | 待提纯的物质 | 选用的试剂 | 主要操作方法 |
| A | 乙醇(水) | 加热蒸发 | |
| B | NaCl溶液(MgCl2) | Ba(OH)2溶液 | 过滤 |
| C | 四氯化碳(碘) | 过滤 | |
| D | CO(CO2) | NaOH溶液,浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
2. 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 若Z是KCl溶液,则电解时溶液中Cl-向Y极移动 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 外加电流的阴极保护法中,Y是待保护金属 | |
| D. | 电解硫酸溶液一段时间后,加适量水可使溶液恢复到原溶液 |
14.同温同压下,等体积的CO和CH4分别在足量的氧气中完全燃烧,消耗O2体积分别为xL和yL,则x与y的比值为( )
| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
 .
.


