题目内容
7. 已知下列反应:
已知下列反应:①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
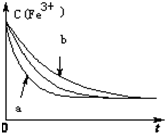
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
分析 (1)溶液呈蓝色的现象,必须铁离子过量,由①2Fe3++2I-?2Fe2++I2(s)(慢);②I2+2S2O32-═2I-+S4O62-(快),所以铁的物质的量大于S2O32-的物质的量;(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
②将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值;
③加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动;
(3)①曲线a达平衡的时间缩短,改变的条件是:加入催化剂;
②曲线b达到平衡的时间增长,改变的条件是:降低反应温度;
(4)可使溶液颜色变浅的是平衡逆向移动,
A.加入少量KCl晶体,平衡不移动;
B.加入少量Na2SO3晶体与铁离子发生氧化还原反应,平衡逆向移动;
C.加入少量Na2CO3溶液,促进铁离子的水解,平衡逆向移动;
D.加入较浓的KSCN溶液,平衡正向移动;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度得到.
解答 解:(1)溶液呈蓝色的现象,必须铁离子过量,由①2Fe3++2I-?2Fe2++I2(s)(慢);②I2+2S2O32-═2I-+S4O62-(快),所以铁的物质的量大于S2O32-的物质的量,所以n(S2O32-):n(Fe3+)<1,故答案为:<1;
(2)①该反应的平衡常数K的表达式为K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$,故答案为:K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$;
②将表中的三组数据代入公式kcm(I-)•cn(Fe3+)
得0.20m×0.80n=0.032,
0.60m×0.40n=0.144,
0.80m×0.20n=0.128,
解之得:m=2,n=1,
所以I-浓度对反应速率的影响大,故答案为:大于;
③加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动,
故答案为:向右;
(3)①曲线a达平衡的时间缩短,改变的条件是:加入催化剂,故答案为:加入催化剂;
②曲线b达到平衡的时间增长,改变的条件是:降低反应温度,故答案为:降低反应温度;
(4)A.加入少量KCl晶体,平衡不移动,颜色不变,故错误;
B.加入少量Na2SO3晶体与铁离子发生氧化还原反应,平衡逆向移动,颜色变浅,故正确;
C.加入少量Na2CO3溶液,促进铁离子的水解,平衡逆向移动,颜色变浅,故正确;
D.加入较浓的KSCN溶液,平衡正向移动,颜色加深,故错误;
故选:BC;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+?Fe3++H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{[\frac{1{0}^{-14}}{c(O{H}^{-})}]^{3}}$=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103,故答案为:2.79×103.
点评 本题考查探究化学反应速率的影响因素,明确反应的现象及控制变量法、影响反应速率及平衡的因素等即可解答,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案| A. | 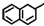 中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 丙烷中所有的原子均在一个平面 | |
| C. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) | |
| D. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
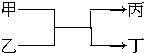 若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙均为短周期,不同主族元素组成的单质,乙、丁都是氧化物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 碳和镁 | B. | 氟气和氧气 | C. | 碳和氢气 | D. | 氧气和硫 |
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | |
| B. | 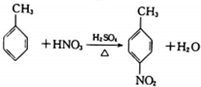 | |
| C. | 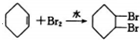 | |
| D. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O |

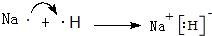 ;
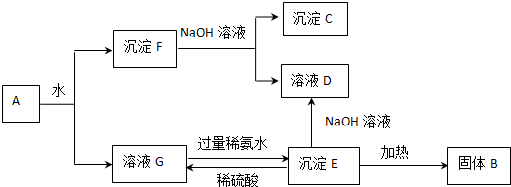
;
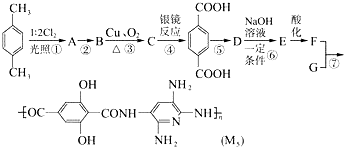
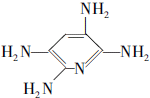 ,F的含氧官能团的名称有羧基、(酚)羟基.
,F的含氧官能团的名称有羧基、(酚)羟基. .
.