题目内容
18.下画是18×7的格子,按要求作答.
(1)用X表示111号元素,在上表中标出
(2)F和H的最高价氧化物对应水化物反应的方程式Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(3)C、E、F的简单离子半径由小到大顺序是A13+<Mg2+<N3-(填写离子符号);
(4)请用电子式表示出A和B形成的化合物形成过程:
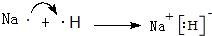 ;
;(5)用实线绘出过渡元素的边框.注意:不得使用铅笔作图.
(6)只由D形成的18电子微粒O22-.
分析 由元素在周期表中结构,可知A为氢、B为Na、C为氮、D为氧、E为Mg、F为Al、H为Cl.
(1)第七周期中零族元素原子序数=18+18+18+32+32=118,则111号元素处于第七周期第11列;
(2)F和H的最高价氧化物对应水化物分别为Al(OH)3、HClO4,二者发生中和反应;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(4)A和B形成的化合物为NaH,属于离子化合物;
(5)短周期没有过渡元素,过渡元素为长周期中第3~12列元素;
(6)只由氧形成的18电子微粒为过氧根离子.
解答 解:由元素在周期表中结构,可知A为氢、B为Na、C为氮、D为氧、E为Mg、F为Al、H为Cl.
(1)第七周期中零族元素原子序数=18+18+18+32+32=118,则111号元素处于第七周期第11列,在周期表中位置: ,
,
故答案为: ;
;
(2)F和H的最高价氧化物对应水化物分别为Al(OH)3、HClO4,二者发生中和反应,反应方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,离子半径为:A13+<Mg2+<N3-,
故答案为:A13+<Mg2+<N3-;
(4)A和B形成的化合物为NaH,属于离子化合物,应电子式表示形成过程为: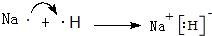 ,
,
故答案为: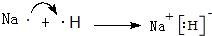 ;
;
(5)短周期没有过渡元素,过渡元素为长周期中第3~12列元素,如图所示: ,
,
故答案为: ;
;
(6)只由氧形成的18电子微粒为O22-,故答案为:O22-.
点评 本题考查元素周期表与元素周期律,熟练掌握元素周期表结构,熟记族与列的关系,掌握根据原子序数确定元素在周期表中位置.

| A. | 甲醛的电子式: | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
| A. | W、Y、Z的非金属性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W、Z形成的某化合物常可用作萃取剂 | |
| D. | WY2分子中既有非极性键又有极性键 |
已知草酸的电离常数K${\;}_{{a}_{1}}$=5.6×10-2,K${\;}_{{a}_{2}}$=5.4×10-5
下列叙述正确的是( )
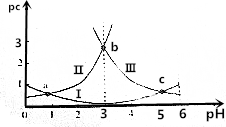
| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
 已知下列反应:
已知下列反应:①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
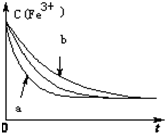
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.


