题目内容
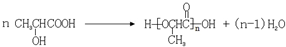
16.下列四个反应中,属于取代反应的是( )| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | |
| B. | 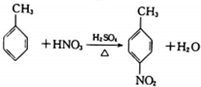 | |
| C. | 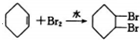 | |
| D. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O |
分析 根据取代反应的定义“有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应”进行判断.
解答 解:A、此反应是乙醛中的碳氧双键和氢气的加成反应,又属于还原反应,不是取代反应,故A错误;
B、此反应是用硝基取代了甲苯中甲基对位的H原子,被取代的H原子和-OH反应生成水,故为取代反应,故B正确;
C、此反应是环己烯中的碳碳双键和溴的加成反应,不是取代反应,故C错误;
D、此反应是一个乙醇分子中的乙基取代了另一个乙醇分子中-OH上的-H原子,故为取代反应,故D正确.
故选BD.
点评 本题考查了取代反应、加成反应、和还原反应的判断,难度不大,正确理解概念是解本题的关键.

练习册系列答案
相关题目
6.表是几种常用燃料的燃烧热:1mol燃料完全燃烧(生成物中的H2O为液态)时放出的热量.
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是甲烷.
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
7. 已知下列反应:
已知下列反应:
①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
①则该反应①的平衡常数表达式为K=$\frac{{c}^{2}(F{e}^{2+})}{{c}^{2}({I}^{-}){c}^{2}(F{e}^{3+})}$;
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
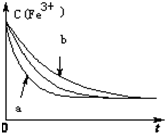
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
 已知下列反应:
已知下列反应:①2Fe3++2I-?2Fe2++I2(s)(慢)
②I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的FeCl3溶液,为确保能观察到溶液呈蓝色的现象,S2O32-与Fe3+初始的物质的量需满足的关系为:n(S2O32-):n(Fe3+)<1.
(2)已知Fe3+与I-在水溶液中发生反应①,该反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)•cn(Fe3+)(其中k为常数).
| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
②由上表数据可知:I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响(填“大于”“小于”或“等于”);
③达到平衡后,往反应混合液中加入一定量的CCl4,则上述平衡向右移动(填“向左”、“向右”、“不会”).
(3)已知反应①在其它条件不变的情况下,只改变一个条件,浓度c(Fe3+)与反应时间t的变化曲线如图所示.则
①曲线a改变的条件是:加入催化剂
②曲线b改变的条件是:降低反应温度
(4)用KSCN溶液检验FeCl3溶液的化学方程式为:FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl
则达到平衡后下列措施可使溶液颜色变浅的是BC
A.加入少量KCl晶体 B.加入少量Na2SO3晶体
C.加入少量Na2CO3溶液 D.加入较浓的KSCN溶液
(5)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,Kw=1×10-14,则该温度下反应:Fe (OH)3+3H+?Fe3++3H2O达平衡时$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=2.79×103.
4.下列各组物质中互为同分异构体的是( )
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
11.法国里昂的科学家最近发现一种由四个中子构成的粒子,这种粒子为“四中子”,也有人称之为“零号元素”.下列有关“四中子”粒子的说法正确的是( )
| A. | 该粒子不显电性 | |
| B. | 该粒子的质量数与${\;}_{z}^{4}$He的相同,两者互为同位素 | |
| C. | 在元素周期表中与氢元素占同一位置 | |
| D. | 1mol该粒子的质量为8g |





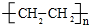 ;
;
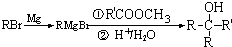 ②
②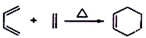
 .
. .
.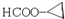 .
.