题目内容
14.常温下,10mL浓度为a mol•L-1的CH3COOH溶液的pH=4.下列能使溶液的pH=7的措施是( )| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
分析 A.根据溶液中的电荷守恒分析;
B.pH=4的醋酸溶液中醋酸的浓度大于10-4mol/L,pH=10的NaOH的浓度等于10-4mol/L;
C.等物质的量的醋酸与氢氧化钠恰好反应生成醋酸钠;
D.稀释103倍促进醋酸电离,pH变化小于3个单位.
解答 解:A.常温下,10mL浓度为a mol•L-1的CH3COOH溶液的pH=4,往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-),溶液中电荷守恒为c(Na+)+c(H+)=c(CH3 COO-)+c(OH-),所以c(H+)=c(OH-),即溶液显中性,pH=7,故A正确;
B.pH=4的醋酸溶液中醋酸的浓度大于10-4mol/L,pH=10的NaOH的浓度等于10-4mol/L,二者等体积混合,醋酸过量,溶液显酸性,则pH<7,故B错误;
C.10mL浓度为a mol•L-1的CH3COOH溶液10 mL浓度为a mol•L-1的NaOH溶液混合,二者等物质的量恰好反应生成醋酸钠,醋酸钠在溶液中水解显碱性,即pH>7,故C错误;
D.将溶液稀释到10 L,即稀释103倍,促进醋酸电离,溶液的pH变化小于3个单位,所以溶液的pH<7,故D错误.
故选A.
点评 本题考查了弱电解质的电离平衡、溶液稀释离子浓度的变化、离子浓度大小的分析判断,题目难度不大,注意电荷守恒的应用,侧重于考查学生的分析能力.,

练习册系列答案
相关题目
10.分子式为C6H12O2并能与饱和NaHC03溶液反应放出气体的有机物(不考虑立体异构有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
5.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是BCD.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
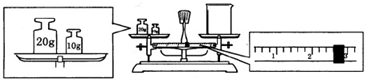
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图.则烧杯的实际质量为27.4g.
(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、250mL容量瓶.(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为检查是否漏水.
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的最浓度为0.084mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为BaCl2(填化学式).
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:④.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图.则烧杯的实际质量为27.4g.

(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、250mL容量瓶.(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为检查是否漏水.
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的最浓度为0.084mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为BaCl2(填化学式).
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:④.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
19.对下列流程有关判断正确的是( )
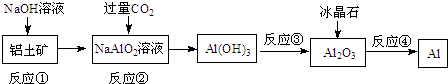

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
6.化学反应终点的判断是化学定量实验的重要环节.下列对化学反应终点的判断不正确的是( )
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
4.现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
 ;
; ;
;