题目内容
4.现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,但反应很快停止;
②B溶液与 C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的名称:X二氧化碳.
(2)鉴别B在溶液中产生的阴离子的实验操作方法是取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-.
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:CO32-+2H+=CO2↑+H2O
B与C反应至溶液呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
(4)D 与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体 bL,则D在混合物中的质量分数为$\frac{(22.4a-197b)}{22.4a}$×100%.
分析 生成的气体只有CO2符合,发生的反应为2H++CO32-=H2O+CO2↑,CO2气体可以和C溶液反应生成沉淀E,则C为Ba(OH)2,沉淀E为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,B与C反应生成的白色沉淀D为硫酸钡,根据物质的性质和反应的有关方程式解答该题.
解答 解:生成的气体只有CO2符合,发生的反应为2H++CO32-=H2O+CO2↑,CO2气体可以和C溶液反应生成沉淀E,则C为Ba(OH)2,沉淀E为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,B与C反应生成的白色沉淀D为硫酸钡,
(1)生成的气体只有CO2符合,发生的反应为 2H++CO32-=H2O+CO2↑,CO2名称为二氧化碳,故答案为:二氧化碳;
(2)B为NaHSO4,在溶液中完全电离生成Na+、H+和SO42-,电离方程式为NaHSO4=Na++H++SO42-,检验SO42-时,取B溶液少量,先加盐酸,无明显现象,再加BaCl2溶液产生白色沉淀,
故答案为:取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-;
(3)A为Na2CO3,B为NaHSO4,A溶液与B溶液反应的实质为:CO32-+2H+=CO2↑+H2O,
B溶液与C溶液反应至中性的离子方程式为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,
故答案为:CO32-+2H+=CO2↑+H2O;2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(4)D与E的混合物ag,加入足量盐酸,发生的反应为BaCO3+2HCl=CO2↑+BaCl2+H2O,
n(CO2)=$\frac{b}{22.4}$mol,n(BaCO3)=n(CO2)=$\frac{b}{22.4}$mol,
m(BaCO3)=$\frac{b}{22.4}$mol×197g/mol=$\frac{197b}{22.4}$g,
m(BaSO4)=ag-$\frac{197b}{22.4}$g,
所以:w(BaSO4)=$\frac{a-\frac{197b}{22.4}}{a}$×100%=$\frac{(22.4a-197b)}{22.4a}$×100%,
故答案为:$\frac{(22.4a-197b)}{22.4a}$×100%.
点评 本题考查离子的推断,为高频考点,把握常见离子之间的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
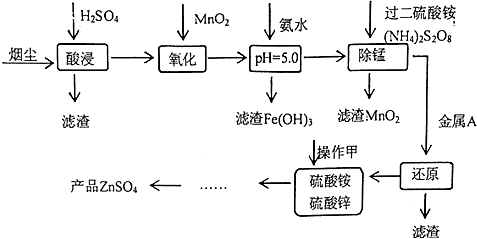
已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.
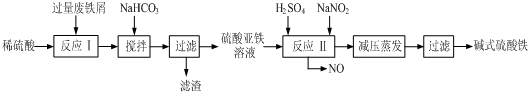
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节PH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(3)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O或Fe2++H2O+NO2-=Fe(OH)2++NO↑+H+,在实际生产中,反应Ⅱ常同时通入O2循环使用产物以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3(或2NO+O2=2NO23NO2+H2O=2HNO3+NO).(用化学方程式表示)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
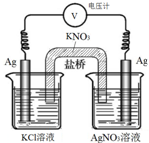 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |