题目内容
19.根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.已知:①SO2+Br2+2H2O→2HBr+H2SO4;
②FeS+2HCl→FeCl2+H2S↑(FeS块状固体难溶于水)
可选用的仪器如图所示:
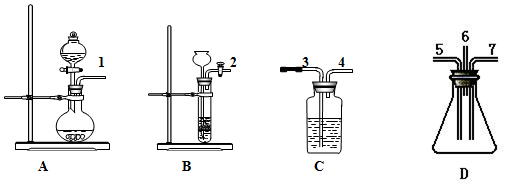
可选用的试剂:
①稀盐酸,②溴水,③Na2SO3粉末状固体,④FeS固体,⑤品红溶液,⑥氢氧化钠溶液,⑦浓硫酸.试回答下列问题:
(1)制取SO2气体选用装置A( 从A--D中选取,填字母),选用的试剂是③和⑦(从①--⑦中选取,填数字).
(2)制取H2S气体选用装置B( 从A--D中选取,填字母),选用的试剂是①和④(从①--⑦中选取,填数字).
(3)表现SO2氧化性的实验是上述仪器中的D装置,有关化学方程式是2H2S+SO2=3S↓+2H2O;表现SO2还原性的实验是上述仪器中的C装置,能观察到的实验现象是溴水褪色.
(4)为了防止污染空气,从装置D出气口排出的气体要用⑥吸收(从①--⑦中选取,填数字).
分析 验证SO2既有氧化性又有还原性的实验,由图可知,A中发生③⑦物质的反应生成SO2,B中发生①④物质的反应生成H2S,在C中加溴水,1与3相连,溴水褪色,发生SO2+Br2+2H2O=H2SO4+2HBr;4与5相连,同时2与7相连,二氧化硫与硫化氢均进入D中发生2H2S+SO2=3S↓+2H2O,为防止污染环境,然后出气口6与3相连,此时C中为NaOH溶液进行尾气处理,以此来解答.
解答 解:验证SO2既有氧化性又有还原性的实验,由图可知,A中发生③⑦物质的反应生成SO2,B中发生①④物质的反应生成H2S,在C中加溴水,1与3相连,溴水褪色,发生SO2+Br2+2H2O=H2SO4+2HBr;4与5相连,同时2与7相连,二氧化硫与硫化氢均进入D中发生2H2S+SO2=3S↓+2H2O,然后出气口6与3相连,此时C中为NaOH溶液进行尾气处理,
(1)制取SO2气体选用装置A,Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,由上述分析可知,A中试剂为③⑦,
故答案为:A,③⑦;
(2)制取H2S气体选用装置为B,发生的离子方程式分别为FeS+2H+=H2S↑+Fe2+,B中试剂为①④,
故答案为:B;①④;
(3)D中发生2H2S+SO2=3S↓+2H2O,S元素的化合价降低,体现二氧化硫的氧化性,观察到装置内壁上有淡黄色的固体析出和液滴生成;C中发生SO2+Br2+2H2O=H2SO4+2HBr,S元素的化合价升高,体现二氧化硫的还原性,观察到溴水褪色,
故答案为:2H2S+SO2=3S↓+2H2O;C;溴水褪色;
(4)该实验中二氧化硫、硫化氢、溴蒸气均为有毒气体,严重污染大气,必须净化后再放空,则装置D的出气管应连接盛有NaOH溶液的C装置3口,选⑥,
故答案为:⑥.
点评 本题考查性质实验方案的设计,为高频考点,把握还原性与氧化性的实验中发生的化学反应进行实验设计为解答的关键,注重氧化还原反应、实验技能、化学与环境的综合考查,题目难度中等.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 锂离子电池和普通锌锰干电池都是二次电池 | |
| B. | 原电池的反应的本质是氧化还原反应 | |
| C. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| D. | 铅蓄电池放电的时候正极是Pb负极是PbO2 |
| A. | 溶剂的质量 | B. | 溶质的质量分数 | C. | KNO3的溶解度 | D. | 溶液中K+的数目 |
| A. | 硫磺粉 | B. | 沙子 | C. | 石灰 | D. | 碱 |
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液出现黑色沉淀
④向盛有新制的银氨溶液的试管中加入几滴乙醛后,未出现银镜
⑤铜丝加热后立即插入乙醇中反应制取乙醛.
| A. | ①④⑤ | B. | ①③④ | C. | ③④ | D. | ①②⑤ |
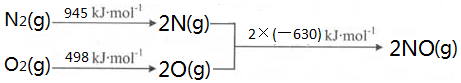
| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ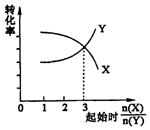 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+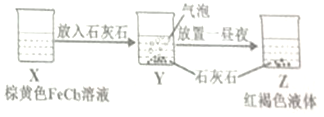 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
| A. | 在某些分子中,化学键可能只有σ键而没有π键 | |
| B. | 分子中σ键的键能一定大于π键的键能 | |
| C. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| D. | SO2形成π键与O3的π键是相似的 |
| A. | 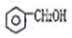 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 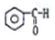 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |