题目内容
2.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 17 g H2O2中含有8NA个电子 | |
| C. | 7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA | |
| D. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA |
分析 A、一水合氨为弱碱,在溶液中部分电离;
B、求出双氧水的物质的量,然后根据双氧水中含18个电子来分析;
C、Na2S和Na2O2的摩尔质量均为78g/mol,且均由2个钠离子和1个阴离子构成;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
解答 解:A、一水合氨为弱碱,在溶液中部分电离,故溶液中的铵根离子的个数小于0.1NA个,故A错误;
B、17g双氧水的物质的量n=$\frac{17g}{34g/mol}$=0.5mol,而双氧水中含18个电子,故0.5mol双氧水中含9NA个电子,故B错误;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g Na2S和7.8g Na2O2的物质的量均为0.1mol,而两者均由2个钠离子和1个阴离子构成,故0.1molNa2S和Na2O2中含有的离子个数均为0.3NA个,故C正确;
D、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,即少于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
18.双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
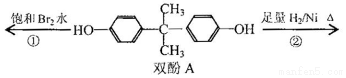

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1mol双酚A最多消耗2mol Br2 | |
| C. | 反应②的产物中只有一种官能团 | |
| D. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
10.下列说法中正确的是( )
| A. | 锂离子电池和普通锌锰干电池都是二次电池 | |
| B. | 原电池的反应的本质是氧化还原反应 | |
| C. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| D. | 铅蓄电池放电的时候正极是Pb负极是PbO2 |
17.合金具有许多优良的物理、化学或机械性能.下列物质属于合金的是( )
| A. | 石墨 | B. | 陶瓷 | C. | 青铜 | D. | 水银 |
7.将80℃饱和KNO3溶液冷却至10℃,有KNO3固体析出.该过程中保持不变的是( )
| A. | 溶剂的质量 | B. | 溶质的质量分数 | C. | KNO3的溶解度 | D. | 溶液中K+的数目 |
14.若不慎将汞温度计打碎在地面上,可在汞滴上覆盖一层物质以避免发生汞中毒,该物质是( )
| A. | 硫磺粉 | B. | 沙子 | C. | 石灰 | D. | 碱 |
11.下列说法不正确的是( )
| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ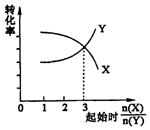 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+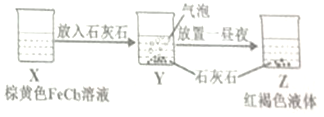 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
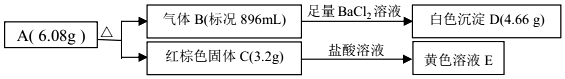
 .
.