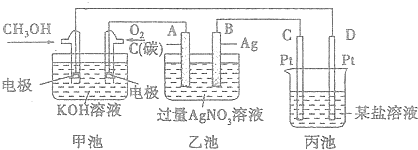
题目内容
2.能正确表示下列反应的离子方程式的是( )| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
分析 A、次氯酸具有氧化性,能够氧化亚硫酸根离子;
B、硫酸根离子完全沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,反应产物为偏铝酸钠;
C、Na2O2与H2O反应生成氢氧化钠和氧气;
D、向FeBr2溶液中通入足量氯气,反应生成氯化铁、溴单质.
解答 解:A、向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO,生成的次氯酸具有氧化性,能够氧化亚硫酸根离子,故A错误;
B、明矾溶液中滴加Ba(OH)2至SO42-完全沉淀,铝离子恰好反应生成偏铝酸根离子,反应的化学方程式为:KAl(SO4)2+2Ba(OH)2=2BaSO4↓+KAlO2+2H2O,对应的离子方程为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故B错误;
C、Na2O2与H2O反应生成氢氧化钠和氧气,2Na2O2+2H2O═4Na++4OH-+O2↑,故C正确;
D、向FeBr2溶液中通入足量氯气,离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D错误.
故选C.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L | |
| C. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1mol Zn,转移的电子总数等于2NA | |
| D. | 5.4g Al分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA |
13.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下
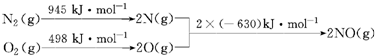
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236KJ/molkJ/mol.(1 molSi有2molSi-Si)
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.

写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
10.有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 读取量筒内溶液液体的体积,俯视读数导致读数偏大 |
17.将新制氯水注入KI溶液中充分反应后,再加CCl4,振荡后静置,看到的现象是( )
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
7.由海水提取金属镁,主要有以下步骤:①在一定条件下脱水干燥;②加石灰乳;③加盐酸;④过滤;⑤蒸发结晶;⑥电解.其先后顺序正确的是( )
| A. | ②④⑤③①⑥ | B. | ③②④①⑤⑥ | C. | ③④②⑤①⑥ | D. | ②④③⑤①⑥ |
12.下列说法中正确的是( )
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |