题目内容
7.由海水提取金属镁,主要有以下步骤:①在一定条件下脱水干燥;②加石灰乳;③加盐酸;④过滤;⑤蒸发结晶;⑥电解.其先后顺序正确的是( )| A. | ②④⑤③①⑥ | B. | ③②④①⑤⑥ | C. | ③④②⑤①⑥ | D. | ②④③⑤①⑥ |
分析 由于海水含有大量的氯化镁,因此常用海水来制备金属镁,大体步骤为:将石灰乳加入海水或卤水中,沉淀出氢氧化镁,氢氧化镁再和稀盐酸反应生成氯化镁,然后对得到的氯化镁溶液蒸发结晶,电解熔融状态的氯化镁,就能得到金属镁.
解答 解:因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着加盐酸将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2•6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2 +6H2O电解熔融的氯化镁获得单质镁,涉及反应:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,正确操作步骤的顺序是②④③⑤①⑥.
故选D.
点评 本题难度不大,主要考查了海水制镁的过程,培养学生解决问题的能力,更全面地了解分离混合物的方法.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
17.在加入酚酞呈红色的某溶液中,能大量共存且溶液为无色透明的离子组是( )
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
18.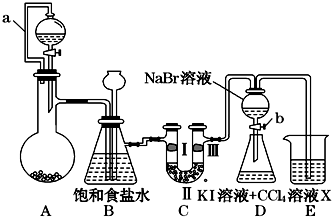 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:
(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O.
(2)本实验目的是制备氯气并探究氯气等物质的相关性质,B装置有几个作用,分别是除去氯气中的氯化氢、安全瓶,检测实验过程中装置是否堵塞.拆去a导管的后果可能是酸不能顺利滴入烧瓶.
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是②.
(4)证明溴的非金属性比碘强的实验操作和现象是实验完毕,打开活塞b,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色.
(5)D装置进行实验时存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,合适的溶液X是①④⑥ (从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择).
 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O.
(2)本实验目的是制备氯气并探究氯气等物质的相关性质,B装置有几个作用,分别是除去氯气中的氯化氢、安全瓶,检测实验过程中装置是否堵塞.拆去a导管的后果可能是酸不能顺利滴入烧瓶.
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是②.
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(5)D装置进行实验时存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,合适的溶液X是①④⑥ (从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择).
2.能正确表示下列反应的离子方程式的是( )
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
12.欲除去下列物质中的少量杂质,请填写所用方法及反应的离子方程式.
| 欲除去的少量杂质 | 方法 | 反应的离子方程式 |
| (1)Na2CO3溶液中的NaHCO3 | ||
| (2)NaCl溶液中的Na2CO3 | ||
| (3)NaHCO3溶液中的Na2CO3 |
19.下列解释事实的离子方程式正确的是( )
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2 I2+2H2O | |
| D. | 服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
16.在一密闭容器中有CO、H2和O2混合气体共20g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是( )
| A. | 60% | B. | 33.3% | C. | 36% | D. | 40% |
