题目内容
17.铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:(1)镓(Ga)简化电子排布式为[Ar]3d104s24p1,镓(Ga)与铟(In)同主族,二者第一电离能的大小顺序为Ga>In(用元素符号表示).按电子排布,可以把周期表里的元素分为5个区,则Cu为ds区.
(2)O、S、Se同主族,其简单氢化物中,沸点由高到低的顺序为H2O>H2Se>H2S,中心原子的杂化方式为sp3,键角最大的是H2O.
(3)第IVA、VA元素形成的化合物中有多种可以用作太阳能电池材料.已知N-N、N≡N键能之比为1:4.9,而C-C、C≡C键能之比为1:2.34.利用这些数据结合结构知识解释氮分子不容易发生加成反应而乙炔分子容易发生加成反应N≡N键能大于N-N键键能的3倍,而C≡C键能小于C-C键键能的三倍,说明乙炔中π键不牢固,容易被试剂进攻,故容易发生加成反应,而氮分子中N≡N非常牢固,不容易发生加成反应.
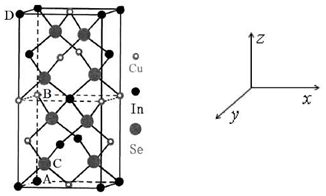
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形成GIGS晶体),该晶体的化学式为CuInSe2,如果将Se原子看做密堆积,则其堆积模型为面心立方最密堆积.
(5)原子在晶胞中的位置科学的表达是原子坐标,晶胞中有多少个不同位置的原子,就有多少个原子坐标.A原子和B原子坐标分别为(0,0,0),(0,0,$\frac{1}{2}$),C原子坐标为($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$).有同学认为可以将D原子坐标记为(0,1,1)你认为是否有必要没有必要(填“有必要”或“没有必要”)
分析 (1)Ga是硼族元素,在周期表中所处的位置是第四周期第IIIA族,按照电子排布规则写出核外电子排布式,硼族元素为B,Al,Ga,In,Tl,第一电离能按从上到下依次减小,按电子排布,可以把周期表里的元素分为5个区,Cu的价电子排布为3d104s1,位处周期表ds区;
(2)O、S、Se同主族,均为氧族元素,其简单氢化物分别为H2O,H2S,H2Se,考虑沸点时,都是分子晶体,主要因素是范德华力,H2O分子之间存在氢键,氢键作用力大于范德华力,二者均属于分子间作用力,导致水的沸点异常的高,对于H2S和H2Se,则是范德华力主导,相对分子质量越高,沸点越高;三者的简单氢化物都含有两对孤电子对,两对键合电子对,则价层电子对数为4,中心原子为sp3杂化,O的电负性比S和Se都大,吸引电子能力强,形成的共用电子对斥力大,键角大;
(3)已知N-N、N≡N键能之比为1:4.9,而C-C、C≡C键能之比为1:2.34,从数据来看,键能越大,键越牢固,破坏键就越困难,据此分析反应的难易的原因;
(4)对于四方晶胞,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,晶胞内部粒子为整个晶胞所有,据此计算晶体的化学式,如果将Se原子视作密堆积,晶体结构与金刚石晶胞相似,Se与周围粒子呈四面体,根据原子坐标分析Se的堆积方式;
(5)根据空间直角坐标系的建立,已知A原子和B原子坐标分别为(0,0,0),(0,0,$\frac{1}{2}$),C与周围四个粒子呈四面体构型,根据立体几何知识分析C的原子坐标,D和A在整个晶胞中都是同种粒子,原子坐标相同.
解答 解:(1)Ga在周期表中所处的位置是第四周期第IIIA族,其核外电子排布式为[Ar]3d104s24p1,
镓(Ga)与铟(In)同主族,第一电离能按从上到下依次减小,则二者第一电离能的大小顺序为Ga>In,
按电子排布,可以把周期表里的元素分为5个区,Cu的价电子排布为3d104s1,位处周期表ds区,
故答案为:[Ar]3d104s24p1;Ga>In;ds;
(2)O、S、Se同主族,其简单氢化物分别为H2O,H2S,H2Se,H2O分子之间存在氢键,氢键作用力大于范德华力,二者均属于分子间作用力,导致水的沸点异常的高,对于H2S和H2Se,则是范德华力主导,相对分子质量越高,沸点越高,因此沸点高低顺序为:H2O>H2Se>H2S,
三者的简单氢化物都含有两对孤电子对,两对键合电子对,则价层电子对数为4,中心原子为sp3杂化,
O的电负性比S和Se都大,吸引电子能力强,形成的共用电子对斥力大,键角大,因此键角最大的是H2O,
故答案为:H2O>H2Se>H2S;sp3;H2O;
(3)已知N-N、N≡N键能之比为1:4.9,而C-C、C≡C键能之比为1:2.34,从数据来看,键能越大,键越牢固,破坏键就越困难,因此氮分子不容易发生加成反应而乙炔分子容易发生加成反应的原因是:N≡N键能大于N-N键键能的3倍,而C≡C键能小于C-C键键能的三倍,说明乙炔中π键不牢固,容易被试剂进攻,故容易发生加成反应,而氮分子中N≡N非常牢固,不容易发生加成反应,
故答案为:N≡N键能大于N-N键键能的3倍,而C≡C键能小于C-C键键能的三倍,说明乙炔中π键不牢固,容易被试剂进攻,故容易发生加成反应,而氮分子中N≡N非常牢固,不容易发生加成反应;
(4)四方晶胞,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,晶胞内部粒子为整个晶胞所有,根据晶胞结构,一个四方晶胞中,有Cu的个数为$6×\frac{1}{2}+4×\frac{1}{4}$=4,有In的个数为$8×\frac{1}{8}+4×\frac{1}{2}+1$=4,有Se的个数为8,因此晶体的化学式为CuInSe2,观察晶胞构型,将晶胞分为一半,Se与周围四个粒子构成的是正四面体,与金刚石晶胞相似,上下两个结构中Se的排列是对应的,任取其中一个结构来看,根据立体几何知识,不难求出Se有4个原子坐标,分别为($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{4}$);($\frac{3}{4}$,$\frac{1}{4}$,$\frac{1}{4}$);($\frac{1}{4}$,$\frac{1}{4}$,$\frac{3}{4}$);($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$),这四个原子坐标显然可以通过如下运算得到:
($\frac{3}{4}$,$\frac{1}{4}$,$\frac{1}{4}$)+($\frac{1}{2},\frac{1}{2},0$)=($\frac{1}{4},\frac{3}{4},\frac{1}{4}$);
($\frac{3}{4},\frac{1}{4},\frac{1}{4}$)+($\frac{1}{2},0,\frac{1}{2}$)=($\frac{1}{4},\frac{1}{4},\frac{3}{4}$);
($\frac{3}{4},\frac{1}{4},\frac{1}{4}$)+(0,$\frac{1}{2},\frac{1}{2}$)=($\frac{3}{4},\frac{3}{4},\frac{3}{4}$);
这是因为晶胞中的坐标参数取值为[0,1),原子坐标中,“1”即“0”!
将四个原子中取任意一个原子的坐标,对其进行+($\frac{1}{2},\frac{1}{2},0$;$\frac{1}{2},0,\frac{1}{2}$;$0,\frac{1}{2},\frac{1}{2}$)运算能得到其余三个原子坐标,几何上相同,化学上相同,这就是面心晶胞的判据!
可见,Se原子是按面心立方最密堆积排布的,
故答案为:CuInSe2;面心立方最密堆积;
(5)晶胞中的坐标参数取值为[0,1),原子坐标中,“1”即“0”,基于这个规则,A原子和B原子坐标分别为(0,0,0),(0,0,$\frac{1}{2}$),从整个晶胞看,根据立体几何知识,不难求出C的原子坐标为($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$),有同学认为可以将D原子坐标记为(0,1,1),显然这是没有必要的,因为“1”即“0”,D的坐标其实就是(0,0,0),与A原子是同种粒子,几何上相同,化学上也相同,
故答案为:($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$);没有必要.
点评 本题考查物质结构知识,包含核外电子排布式,电离能的判断,氢键的性质,粒子的空间构型,电负性,晶胞计算等知识,考查得很综合.值得一提的是,(4)和(5)均是难题,考查的是晶体学知识,原子坐标的计算,面心晶胞的判断其实是大学无机化学的知识,需明确原子坐标中“1”即“0”是问题的关键.本题总体来讲,是中等难度题.

| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在上述元素中,金属性最强的是Na.
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)只由④形成的18电子微粒.O22-.
(4)写出②的最高价氧化物的电子式
 .
.(5)用电子式表示⑦和⑨形成的化合物的形成过程
 .
.(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式F-N=N-F.
| A. | 蛋白质溶液中加入Na2SO4溶液可使其变性 | |
| B. | 氨基酸具有两性,既能与酸反应又能与碱反应 | |
| C. | 蔗糖既能发生水解反应,又能发生银镜反应 | |
| D. | 纤维素在人体内不能水解生成葡萄糖,因此对人体健康无益 |
| 编号 | 实 验 操 作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置 于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 将CO2通入Na2SiO3水溶液观察是否有沉淀产生 | 探究碳和硅两元素非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 农药波尔多液不能用铁制器皿盛放 | |
| B. | 维生素C能帮助人体将摄取的Fe3+还原为Fe2+,这说明维生素C有还原性 | |
| C. | 用硫酸可以洗去锅炉水垢 | |
| D. | 氮气常用作保护气,如填充灯泡、焊接保护等 |
①有化学键被破坏的变化就是化学变化
②用化学键的强弱可以判断氯化钠与溴化钠,氯化氢与溴化氢的熔沸点高低
③质子数相同的微粒不一定是同种元素
④如果ⅡA族某元素原子序数为x,则同周期ⅢA族的元素的原子序数为x+1
⑤如果三周期某元素原子序数为x,则同主族四周期的元素的原子序数为x+8
⑥ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物酸性越强.
| A. | ①②④⑤ | B. | ③⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
| A. | 易溶于水 | B. | 是天然气的主要成分 | ||
| C. | 点燃前不需要验纯 | D. | 与乙烷互为同分异构体 |

| A. | 乙醇不能使酸性高锰酸钾溶液褪色 | |
| B. | 物质B的溶液不能与碳酸钙反应 | |
| C. | CH3COOCH2CH3的同分异构体中能与碳酸氢钠溶液反应的有两种 | |
| D. | 反应④属于取代反应 |
