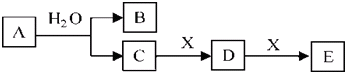
题目内容
14.下列关于热化学反应的描述,正确的是( )| A. | CO(g)燃烧热△H=-283.0 kJ•mol-1,则反应2CO2(g)=2CO(g)+O2(g)的△H=2×283.0kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,说明金刚石比石墨稳定 | |
| D. | 相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热不相同 |
分析 A、根据燃烧热的概念结合热化学方程式的特点分析;
B、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
C、物质具有的能量越低越稳定;
D、反应热与条件不相干,与物质的聚集状态有关.
解答 解:A、CO(g)的燃烧热是283.0kJ/mol,则表示燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol,当方程式反写△H符号相反,计量数变化几倍△H也要变化几倍,所以2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故A正确;
B、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ba(OH)2反应生成的水是几摩尔,其中和热恒为57.3KJ/mol,故B错误;
C、石墨转化为金刚石吸热,说明石墨的能量较低,能量越低越稳定,因此石墨比金刚石稳定,故C错误;
D、反应热与条件不相干,与物质的聚集状态有关,故相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热相同,故D错误;
故选A.
点评 本题考查学生反应热的有关知识,注意对中和热和燃烧热的概念理解,以及物质的稳定性等知识,难度不大.

练习册系列答案
相关题目
3.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | “真金不怕火炼”说明有些金属(例如金)即使在高温下也不与氧气发生反应 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 含重金属离子的电镀废液不能随意排放 | |
| D. | 铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
5.下列反应中,属于吸热反应的是( )
| A. | 氢气在在氯气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | CaCO3与稀盐酸反应制取CO2 | D. | CaO溶于水 |
9.把镁带投入盛有盐酸的敞口容器里,在下列因素中对反应速率有影响的是:( )
①盐酸的浓度
②镁带的表面积
③溶液的温度
④压强.
①盐酸的浓度
②镁带的表面积
③溶液的温度
④压强.
| A. | ①② | B. | ③④ | C. | ①②③④ | D. | ①②③ |
6.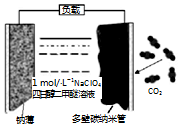 可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
 可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )| A. | 放电时,Na+向正极移动 | |
| B. | 放电时,电子从钠薄经负载流向多壁纳米碳管 | |
| C. | 充电时,钠薄和外接电源的负极相连,发生氧化反应 | |
| D. | 充电时,阳极的电极反应为:2Na2CO3+C-4e-═4Na++3CO2↑ |
4.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
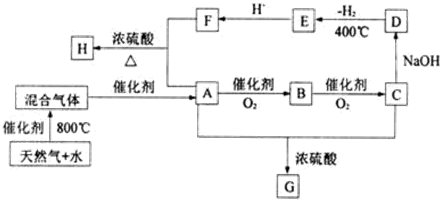
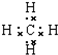 ;E的化学式是Na2C2O4.
;E的化学式是Na2C2O4.